您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-30 16:03
为鼓励创新医疗器械的发展,FDA设立了突破性器械认定(Breakthrough Device Designation, BDD)和更安全技术计划(Safer Technologies Program, STeP),旨在确保患者能够获得更多高质量、安全的治疗机会。通过BDD和STeP的产品可以进行优先审评,进一步缩短研发、上市的时间。本文小编将从认定对象、认定标准、申请流程、利好政策及获批数据情况五方面对两项计划进行介绍。
突破性器械认定(BDD)
突破性医疗器械认定(Breakthrough Device Designation, BDD)是FDA 2018年设立的一项针对创新器械的加速上市程序,旨在帮助罹患重大不可逆疾病的患者获得更多治疗机会。
1、BDD对象
器械或以器械为主的组合产品。
2、BDD标准及申请流程
申请人可在提交器械上市申请前的任何时间申请BDD,认定标准及申请流程参阅下图:

3、BDD标准符合性论证要点
1) 产品相关的适应证及其发病率和死亡率情况;
2) 产品相关适应证的临床诊疗流程是什么?
3) 产品在临床诊疗中的哪个环节应用,主要的目标人群;
4) 产品的预期用途是否明确?
5) 同临床诊疗方法相比,产品的优势是什么,对患者的临床结局有哪些改善?
6) 比临床标准诊疗方法更有效的证据有哪些?
7) 产品在哪些技术具有领先水平?
8) 是否有相同预期用途的产品存在?
9) 相较已有方法,任何能够使患者受益的方面。
4、BDD利好政策
获批BDD后,申请人可通过多种方式获得器械开发的反馈意见,包括冲刺讨论(sprint discussions)、数据开发计划讨论、临床试验方案讨论。此外,申请人还将在今后提交的器械监管申请中获得优先审评,包括Q-Submission、IDE申请和上市申请,进一步缩短研发、上市时间。
5、BDD获批数据情况
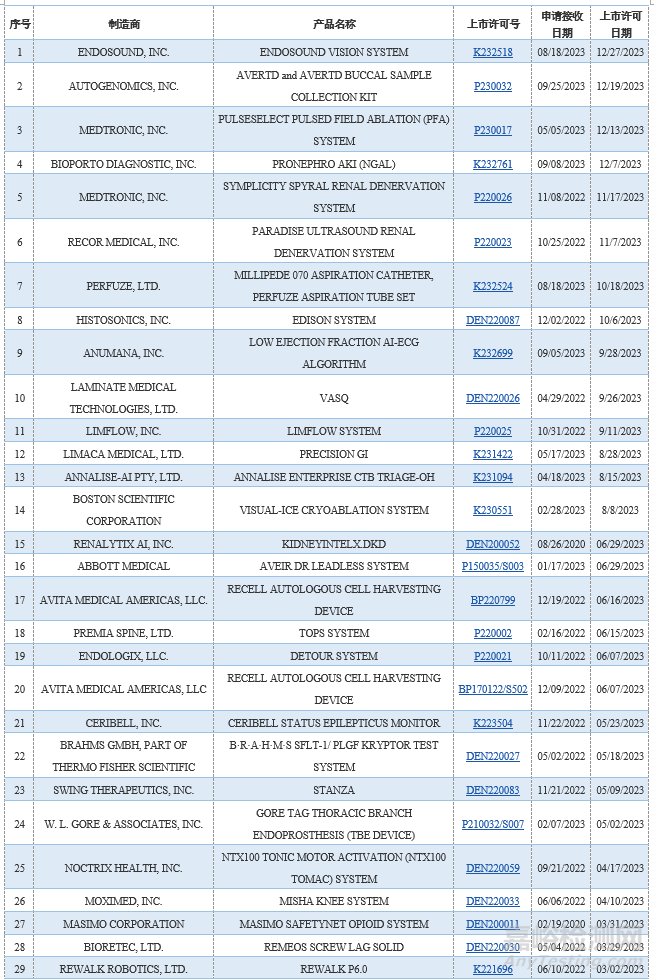
截至2023年12月31日,共计933款器械获批BDD(之前通过EAP计划纳入的器械也计算在内),其中的95款获得上市许可。在获得上市许可之前,FDA不会公开披露BDD申请情况和该申请的批准情况。以下为FDA官网列示的2023年已获得上市许可的BDD:

更安全技术计划(STeP)
STeP是FDA 2020年推出的快速审评途径,旨在加速能够显著提高现有治疗方法安全性的器械的开发和上市,这些器械所涉及的疾病没有突破性器械计划所涵盖的那么严重,包括用于治疗或诊断非危及生命或可合理逆转的疾病或病症的器械。
1、STeP认定对象
同BDD对象,为器械或以器械为主的组合产品。
2、STeP认定标准及申请流程
STeP认定标准如下(同时满足):
1) 由于器械治疗、诊断或预防的疾病或病症的严重程度较低,不符合BDD条件;
2) 安全性改进满足以下其中之一:已知严重不良事件发生率降低;减少已知器械故障模式的发生率;减少已知的与使用有关的危害或使用错误的发生;提高另一种器械或干预措施的安全性。
同BDD申请时间相同,申请人可在提交器械上市申请前的任何时间申请STeP。
STeP具体申请流程可参考BDD,其中,符合性评估和Q-Sub递交申请材料两个步骤应按照STeP认定标准和申请材料提交。STeP申请材料包括:器械描述、拟议适应证、预期的安全性改进、监管历史、STeP标准符合性研究资料、拟上市途径及其理由。
3、STeP标准符合性论证要点
1) 器械预计在与其他治疗方法/标准护理相比时显著改善受益-风险比;
2) 器械预计在通常与特定治疗相关的安全问题的发生率和/或严重性方面带来临床上有意义的改进;
3) 预期的安全改进不影响器械的有效性;
4) 安全创新不应引入新的严重不良时间或使用相关的危害,并且对器械的受益-风险比没有负面影响;
5) 预期改进是否实现实质性的安全创新(创新的技术特征或技术的使用)。
4、STeP利好政策
纳入STeP之后,申请人除不能通过临床试验方案讨论方式获得器械开发的反馈意见外,其余均与BDD利好政策相同。
5、STeP获批数据情况
FDA既不公示纳入STeP的器械,也不公开纳入STeP后已上市的器械。
总结
BDD重点在于论证器械的临床有效性和满足重大医疗需求,STeP偏向于论证器械预期的安全性改进和减少风险,此外在认定对象、评定周期、申请提交时间、提交方式以及获得FDA加速指导流程上大体相似。但因为突破性器械是法定任务,如果出现项目配套资源不足的情况,FDA将优先BDD项目。
参考资料:
1.Breakthrough Devices Program | FDA
2.Safer Technologies Program (SteP) for Medical Devices | FDA
3.Requests for Feedback and Meetings for Medical Device Submissions: The Q-Submission Program (fda.gov)

来源:苏大检测


