您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-09-30 20:47
刚刚,北京药监局发布《北京市聚合酶链反应(PCR)检验实验室检查指南(2024版)(征求意见稿)》,内容如下:
北京市聚合酶链反应(PCR)检验实验室检查指南(2024版)
(征求意见稿)
聚合酶链反应检验实验室是指通过基因扩增的方式检测特定的DNA或RNA的检验实验室。聚合酶链反应(Polymerase Chain Reaction,PCR)是一种在体外特异性扩增靶DNA序列的技术,其基本过程为模板双链DNA的变性、引物与模板DNA的退火和在DNA聚合酶引导下的链延伸反应三个阶段的多次循环。每一次循环后的扩增产物均可作为下一轮循环的模板,理论上,扩增产物量呈指数形式上升,即经过n个循环后,产物量增加到2n倍。PCR试剂操作简单,短时间内在体外可获得数百万个特异靶DNA序列的复制,为临床疾病的诊断、治疗监测和预后评估提供了一种极有帮助的实验室辅助手段。
PCR检验实验室是PCR试剂生产企业在产品检验过程中不可缺少的工作环境,其环境控制水平和质量管理水平直接影响着最终产品是否合格,能否放行。由于该产品本身的特殊性,《医疗器械生产质量管理规范附录体外诊断试剂》、《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》条款中,对PCR试剂的生产和检验环境做出明确规定。此外现行卫生行业的法规、标准以及相关文献中对于PCR检验实验室均作出规定,主要涉及《全国临床检验操作规程》(第四版)、《医疗机构临床基因扩增管理办法》(卫办医政发〔2010〕194号)、《医疗机构临床基因扩增检验实验室工作导则》及《临床诊断中聚合酶链反应(PCR)技术的应用》(WS/T 230-2002)等行业标准的相关要求。
本检查指南旨在帮助北京市医疗器械监管人员增强对PCR检验相关过程的认知和把握,指导全市医疗器械监管人员对PCR检验实验室设计建设与质量控制的监督检查工作。同时,为PCR试剂生产企业在PCR检验实验室的设计建造和管理要求提供参考。
本指南中涉及或引用的国家相关法律、法规、规章、标准、检查指南等发生内容或效力变化时,要以当时执行的最新版为准。必要时,北京市药品监督管理局应重新研究修订,以确保本指南持续符合要求。
一、适用范围
本检查指南可作为北京市药品监督管理局组织、实施的体外诊断试剂产品注册质量管理体系现场核查、医疗器械生产许可现场检查、医疗器械生产监督检查等涉及PCR检验实验室检查的参考资料。
基因测序检验实验室等涉及PCR试剂的相关部分应当参照本检查指南执行。
二、检查要点
(一)现场查看生产企业PCR检验实验室布局
生产企业应当提供PCR检验实验室设计方案和/或平面设计图(应当标明风向或压差梯度)。
1.PCR检验实验室与PCR试剂生产区域应当在各自独立的建筑物或空间内,保证空气不直接连通,防止扩增时形成的气溶胶造成交叉污染。
2.原则上PCR检验实验室应当设置以下区域:试剂储存和准备区、标本制备区、扩增区、扩增产物分析区。根据使用仪器的功能,区域可适当合并。若使用实时荧光定量PCR仪且不需要进行后续产物分析工作,扩增区、扩增产物分析区可合并。若使用样本处理、核酸提取及扩增检测为一体的自动化分析仪,则标本制备区、扩增区、扩增产物分析区可合并。合并的区域建议参考扩增区或扩增产物分析区要求进行条件控制。
3.各区域在物理空间上应当完全相互独立,各区域无论是在空间上还是在使用中,应当始终处于完全的分隔状态。不应当只是形式上的分区,不应当是一个区域嵌套一个区域。
4.各区域不应当有空气的直接相通。扩增区与扩增产物分析区各区域宜采用独立直排方式出风。采用空调机组方式的,PCR检验实验室应当具备独立空调机组;同时应当考虑停机后各房间空气连通的可能性,采取必要的控制措施。
5.按照试剂储存和准备区→标本制备区→扩增区→扩增产物分析区方向空气压力应当以递减的方式进行,使得PCR检验实验室的空气流向应当按照试剂储存和准备区→标本制备区→扩增区→扩增产物分析区方向进行,防止扩增产物顺空气气流进入扩增前的区域。空气流向应当为单向,禁止下游污染上游。应当设置合理的压差梯度,并安装压差监测装置,以有效证明空气流向,压差梯度不宜低于5帕。PCR检验实验室建设可参考附件进行设计。
6.设置缓冲间的,缓冲间内通向实验室和走廊的门应当安装互锁装置或采取相应措施,避免出现两个门同时打开的情况。
7.各区间若设置传递窗,应当为双侧开门,要求密封严实,并且两侧的门应当为互锁装置或采取相应措施确保两侧门不会同时开启。同时应当考虑各区间的空气不会通过传递窗互串。
(二)现场查看仪器设施配置
1.试剂储存和准备区的功能:储存试剂的制备、试剂的分装和扩增反应混合液的准备,以及离心管、吸头等消耗品的贮存和准备。配套用品一般应当包括:
(1)符合试剂储存温度要求的冰箱;
(2)混匀器;
(3)离心机;
(4)水浴箱或加热模块;
(5)微量加样器;
(6)紫外消毒设备;
(7)消耗品:一次性手套、一次性口罩、一次性帽子、耐高压处理和(或)一次性的离心管和加样器吸头;
(8)专用工作服和工作鞋(套);
(9)专用办公用品。
2.标本制备区的功能:核酸(RNA、DNA)提取、贮存及加样。配套用品一般应当包括:
(1)符合试剂储存温度要求的冰箱;
(2)高速离心机;
(3)混匀器;
(4)水浴箱或加热模块;
(5)微量加样器;
(6)紫外消毒设备;
(7)生物安全柜;
(8)核酸自动提取仪;
(9)消耗品:一次性手套、一次性口罩、一次性帽子、耐高压处理和(或)一次性的离心管和加样器吸头(带滤芯);
(10)专用工作服和工作鞋(套);
(11)专用办公用品;
(12)如需处理大分子DNA,应当具有超声波仪。
3.扩增区的功能:cDNA合成、DNA扩增及检测。配套用品一般应当包括:
(1)核酸扩增仪;
(2)离心机;
(3)紫外消毒设备;
(4)消耗品:一次性手套、一次性口罩、一次性帽子、耐高压处理和(或)一次性的离心管和加样器吸头(带滤芯);
(5)专用工作服和工作鞋(套);
(6)专用办公用品。
4.扩增产物分析区的功能:扩增片段的进一步分析测定。视检验方法不同而定,基本配置如下:
(1)分析设备;
(2)微量加样器;
(3)紫外消毒设备;
(4)冰箱;
(5)消耗品:一次性手套、一次性口罩、一次性帽子、加样器吸头(带滤芯);
(6)专用工作服和工作鞋(套);
(7)专用办公用品。
上述各区域仪器设备配备为基本配备,实验室应当根据使用的扩增检测技术或试剂的特点,对仪器设备进行必要的增减。
5.设备的维护保养
应当建立设备维护保养规程,计量设备应当定期检定或校准。例如核酸扩增仪、微量加样器、生物安全柜应当每年进行检定或校准工作。
(三)现场检查工作流程及注意事项
1.单次实验进入各工作区域应当严格按照单一方向进行,即试剂储存和准备区→标本制备区→扩增区→ 扩增产物分析区。
2.各工作区域必须有明确的标记,不同工作区域内的设备、物品不得混用。
3.不同工作区域的工作服应当加以区分,不得混用(例如可以采用不同颜色)。
4.实验室的清洁应当按照试剂储存和准备区→标本制备区→扩增区→扩增产物分析区的方向进行。不同的实验区域应当有其各自的清洁用具并防止交叉污染。实验垃圾属于医疗废物的应当按照《医疗废物管理条例》相关规定进行处理。
5.工作结束后,应当立即对工作区进行清洁及消毒。
6.储存试剂和用于标本制备的消耗品等材料应当直接运送至试剂储存和准备区,不能经过扩增检测区及扩增产物分析区。应当对加样吸头、PCR反应管等消耗品进行处理,防止污染。试剂盒中的阳性对照品和(或)质控品应当保存在标本制备区。试剂应当使用分子生物学级别试剂,溶剂不应当对产品检验造成干扰。质检用于原辅料、半成品、成品检验用的PCR反应试剂应当有相应的质量标准及操作程序。
7.为避免样本间的交叉污染,加入待测核酸后,应当盖好含反应混合液的反应管。应当注意PCR反应液加样的顺序,一般应当先加阴性物质后加阳性物质。对具有潜在传染危险性的材料,应当在生物安全柜内开盖,并有明确的样本处理和灭活程序。
8.应当避免气溶胶所致的污染,尽量减少在不同区域内的走动,扩增反应管不得在扩增区打开。
9.扩增产物分析区有可能存在某些可致基因突变和有毒物质如溴化乙锭、丙烯酰胺、甲醛或放射性核素等,应当注意实验人员的安全防护,必要时配备通风橱等防护设备。
(四)现场检查人员培训情况
参与PCR检验的工作人员应当具备相应的专业知识和技能,包括能熟练操作相关设备,明确整个工作的流程,掌握出现污染情况的处理方法以及实验室质量控制方法和检测结果的解释。
检查人员可以通过询问或要求人员实际操作对其进行评价,也可以通过查阅人员培训记录,对其进行评价。
(五)现场检查文件情况
在检查过程中应当特别注意现场查看、询问、记录的实际情况与生产企业的文件规定、记录的符合性。
附1
理想的PCR检验实验室设计

图A 缓冲间为负压的理想PCR检验实验室设置模式
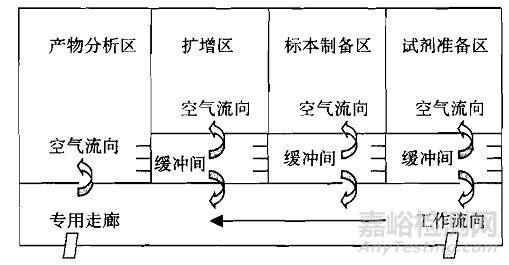
图B 缓冲间为正压的理想PCR检验实验室设置模式
图A和图B所给出的PCR检验实验室设置图是较为理想的设置模式,建议企业参照此种模式设计并建立实验室。
附2
参考资料
1.《关于发布医疗器械生产质量管理规范的公告》(国家食品药品监督管理总局公告2014年第64号)
2.《关于发布医疗器械生产质量管理规范附录体外诊断试剂的公告》(国家食品药品监督管理总局公告2015年第103号)
3.《关于印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知》(食药监械监〔2015〕218号)
4.《生物安全实验室建筑技术规范》(GB 50346-2011)
5.《实验室生物安全通用要求》(GB 19489-2008)
6.《临床诊断中聚合酶链反应(PCR)技术的应用》(WS/T 203-2002)
7.全国临床检验操作规程[第4版]
附件2
《北京市聚合酶链反应(PCR)检验实验室检查指南(2024版)》修订说明
为了贯彻落实《医疗器械生产质量管理规范》及相关配套文件要求,加强北京市医疗器械生产科学监管,指导和规范北京市医疗器械生产企业监督检查工作,帮助检查人员增强对聚合酶链反应(PCR)检验实验室检查要点的认识和掌握,明确对企业聚合酶链反应(PCR)检验实验室的基本要求,北京市药监局结合相关法规及标准变化情况,以及北京市监管工作实际,组织对《聚合酶链反应(PCR)检验实验室检查要点指南(2016版)》进行了修订。
一、修订背景
原北京市食品药品监督管理局组织编制了《聚合酶链反应(PCR)检验实验室检查要点指南(2016版)》,旨在帮助北京市医疗器械监管人员增强对PCR检验相关过程的认知和把握,指导全市医疗器械监管人员对PCR检验实验室设计建设与质量控制的监督检查工作。同时,为PCR试剂生产企业在PCR检验实验室的设计建造和管理要求提供参考。
为进一步落实新版医疗器械生产监管法规和相关标准要求,我局于今年组织开展对《聚合酶链反应(PCR)检验实验室检查要点指南(2016版)》进行了修订,结合相关法规及标准变化,以及本市医疗器械监管人员的监管实践,进一步指导相关医疗器械生产企业做好PCR检验实验室的管理工作。
二、修订思路
结合相关法规、标准要求的变化,以及北京市PCR检验实验室的监管实际,对原指南有关内容进一步修改完善,有效落实医疗器械法规、标准要求,对北京市PCR检验实验室相关监管工作进行科学指导,全力提升科学监管工作水平。
三、主要修订内容
此次修订,主要对以下内容进行了修改和完善:
(一)法规和标准内容的更新
对原指南中已作废或更新的法规和标准进行更新,如将《生物安全实验室建筑技术规范》(GB 50346-2004)更新为《生物安全实验室建筑技术规范》(GB 50346-2011),将《全国临床检验操作规程》[第3版]更新为《全国临床检验操作规程》[第4版]。
(二)结合监管实践对指南内容进行完善
结合近年来医疗器械生产监管人员在对PCR实验室监督检查过程中的实践经验进行梳理和分析,并在指南中进行了完善。如对不同功能区域的仪器设施配置进行了补充和完善,将“温度调控范围为2℃~8℃和(或)-20℃以下冰箱”调整为“符合试剂储存温度要求的冰箱”,标本制备区新增了“核酸自动提取仪”,扩增区删除“微量加样器”等,并明确企业应当根据使用的扩增检测技术或试剂的特点,对仪器设备进行必要的增减,以提高本指南的适用性和可操作性。

来源:北京药监局


