您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-11-05 08:21
细胞毒性检测法(Calcein-AM/PI双染法)是一种常用的细胞活力和毒性评估方法。其原理基于细胞膜的完整性和代谢活性两个关键指标。在实验中,通过使用两种荧光染料Calcein-AM和PI(Propidium Iodide),可以快速准确地评估细胞的状态。
Calcein-AM是一种脂溶性的非荧光染料,可以穿过完整的细胞膜进入细胞内部。在细胞内,Calcein-AM会被细胞内的酯酶水解成为高度荧光的Calcein。只有活着的细胞才能将Calcein-AM水解成Calcein,因此高荧光信号表明细胞的代谢活性和细胞膜完整性良好。而PI是一种核酸染料,只有在细胞膜受损时才能进入细胞内结合DNA并发出红色荧光。因此,当细胞膜受损时,PI会进入细胞并与DNA结合,发出红色荧光信号。
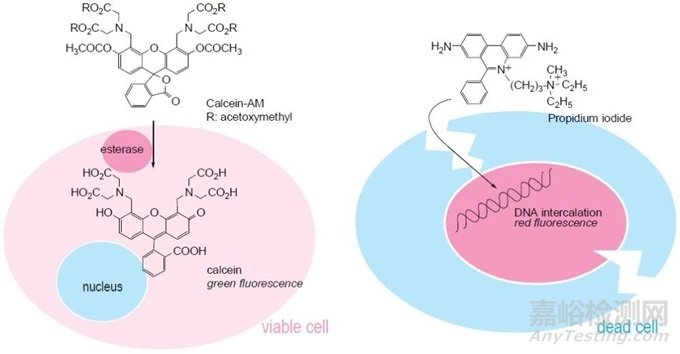
通过同时观察Calcein的绿色荧光和PI的红色荧光,可以区分出三种细胞状态:活着的细胞(只有绿色荧光),死亡的细胞(只有红色荧光),以及受损但仍存活的细胞(同时有绿色和红色荧光)。根据荧光信号的强弱和分布,可以定量和分析不同条件下细胞的存活率和毒性程度,从而评估药物的毒性、细胞培养的质量以及其他相关的生物学研究问题。
一、实验步骤
1、制备工作液
1)首先,将保存在低温环境中的Calcein-AM溶液(2 mM)和PI溶液(2 mM)搁置至室温。
2)随后,取出5µl Calcein-AM溶液(2 mM)和12.5µl PI溶液(2 mM),并加入到含有5ml pH值为7.4的1倍PBS缓冲液中。将混合液彻底混匀。这一步骤完成后,得到的工作液中,Calcein-AM的浓度为2µM,而PI的浓度为5µM。
2、染色
1)首先,使用胰酶-EDTA对细胞进行消化,然后以1000 rpm的速度进行离心5分钟,收集细胞。
2)弃上清,并使用pH值为7.4的1xPBS缓冲液洗涤细胞2~3次,以消除残留的酯酶活性。
3)对细胞进行计数,并调整细胞悬液的浓度至1×10^5~1×10^6细胞/ml。
4)取100µl染色工作液加入200µl细胞悬液中,混匀后在37℃下孵育15-30分钟。
5)使用490±10 nm的激发滤片在荧光显微镜下同时检测活细胞(黄绿色荧光)和死细胞(红色荧光)。此外,使用545 nm的发射滤片仅可观察到死细胞。也可直接在荧光酶标仪下使用适当的滤片进行检测。
二、注意事项
1、鉴于不同细胞系对最佳染色条件的需求有所差异,建议在初次实验时进行梯度实验,以确定Calcein-AM和PI的最佳浓度。
2、由于培养基中的成分如血清含有酯酶,Calcein-AM在遇水时会分解,导致背景信号上升。因此,需要多次离心,并使用PBS缓冲液反复洗涤,直到细胞完全洗净。
3、在进行碘化丙啶(PI)操作时务必注意防护措施。如果碰到皮肤,应立即用自来水进行冲洗。
4、初次使用Calcein-AM溶液和PI溶液时,建议对原液进行分装,以降低反复冻融的频率。
5、由于 Calcein-AM 的稳定性较差,所以此染色工作液必须现配现用,以免影响实验的进行。

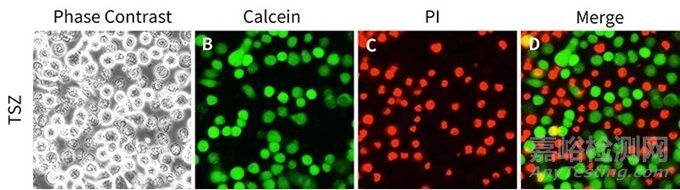
如图为Calcein-AM/PI双染法细胞存活测定,活细胞(绿色荧光)和死细胞(红色荧光)

来源:实验老司机


