您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-02-14 08:45
我们知道在实验室检测系统性能验证中有精密度和正确度验证实验,可以通过这些实验评估检测系统的分析总误差。但是这种评估仅仅能针对某些浓度水平的分析总误差,并不完全代表、适用于临床真实检测环境的宽浓度范围的分析总误差评估。此外,分析总误差应包含了被评估检测系统的随机测量误差、系统测量误差、分析特异性问题、线性问题和干扰问题等。因此,我们要参考特定的标准或指南去进行分析总误差的评估,而不是只通过精密度、正确度验证去间接评估。当然,分析总误差的评估不能替代精密度、正确度、线性和干扰试验等性能验证实验,并且最好在以上性能指标满足相关要求、检测系统正常、室内质控在控(至少两个浓度水平室内质控品)的情况下进行分析总误差评估实验。
2013年当时的国家卫计委曾发布过WS/T409《临床检测方法分析总误差的确定》行业标准。随着医学体外诊断的发展,尤其是医学实验室检验质量控制管理不断规范化、专业化,2024年国家卫健委发布了WS/T409-2024《临床定量检测方法分析总误差的评估》代替2013年版行业标准。该新标准于2024年11月正式实施。下面将具体介绍一下新旧两版主要内容上的一些变化。
相较旧版主要变化如下:
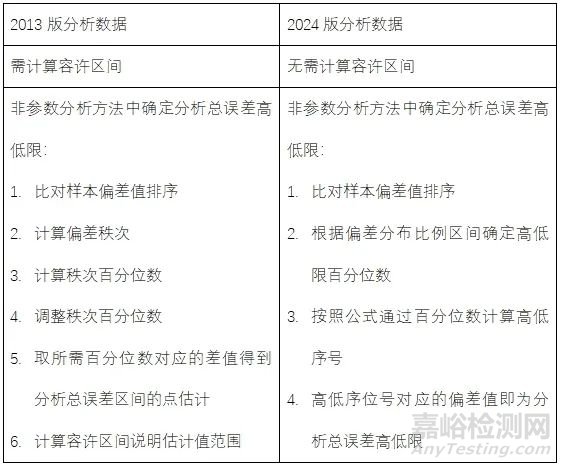
1.删除了2013版中容许区间的描述和相关计算。
2.简化了数据分析方法:删除了容许区间计算、简化分析总误差高低限确定。
3.增加了允许总误差定义描述。
4.增加了测量不确定度定义描述。
5.扩展了比对方法,便于实验室实施和应用。
6.对于检测方法和比对方法测定的次数做了具体规定。
一、取消了容许区间计算,简化数据分析
2013版中无论是采用非参数分析方法,还是采用参数分析方法(要求比对样本偏差整体成正态分布)分析,计算出分析总误差估计值后,都需要计算容许区间(在规定的置信水平下,抽样总体指定的比例范围)来说明该值的范围。新版取消了计算容许区间,即只需计算比对样本偏差分布在特定比例(通常为90%、95%或99%)所包含的区间即可,该区间作为分析总误差值范围。
在非参数分析方法中,新版通过确定的分析总误差的低限百分位数(PL)和高限百分位数(PH)(如果区间设为90%,则高低限百分位分别为0.950和0.050;如果区间设为95%,则高低限百分位分别为0.975和0.025;如果区间设为99%,则高低限百分位分别为0.995和0.005)即可使用给定公式计算上述百分位数相应的高低序位号(比对样本偏差先进行升序排列),高低序位号对应的偏差值即为分析总误差高低限。
新版提供的方法及公式化表述比2013版相关内容(通过计算比对样本偏差秩次百分位数后取所需百分位数对应的差值得到分析总误差区间的点估计)更加简化明确。总而言之,以上统计方法或表述的变动很大程度上减轻了统计分析工作,更加便于实际操作。
WS/T 409-2013统计分析章节截图:

WS/T 409-2024统计分析章节截图:

最后,新版对于统计分析方法的选择也有建议:当标本量不少于120个时,建议采用非参数统计方法计算分析总误差;当标本量少于120个而不少于 40个时,建议采用非参数和参数两种方法计算分析总误差,以两者计算数值中较大者与允许总误差相比较,以判断检测方法是否满足允许总误差的要求。
二、新增定义描述
2024版较2013版新增了允许总误差(2013版描述为总分析误差目标)及测量不确定度定义描述,阐述了误差与测量不确定度的区别,明确了分析总误差与允许总误差的应用。
1、 误差与测量不确定度的区别:误差是单个数值,原则上已知误差的数值可以用来修正结果,是针对方法学的指标。对于测量值应使用测量不确定度,测量不确定度是指根据所用到测量相关的信息,表征赋予被测量量值分散性的非负参数。对大多数医学实验室的检测项目而言,测量不确定度大小与测量值高低相关,一般不能用不确定度数值修正测量结果。此外,误差和不确定度的差别还表现在:修正后的分析结果可能非常接近于被测量的真值,因此误差可以忽略;不确定度可能很大,因为评定方式不同;测量结果的不确定度不可以解释为代表了误差本身或经修正后的残余误差。
2、 分析总误差的应用:当分析总误差(ATE)低限和/或高限超出允许总误差(TEa)时,该检测方法不宜用于临床检测。允许总误差与分析总误差的低限和/或高限比值越大,检测方法越能满足临床需求。
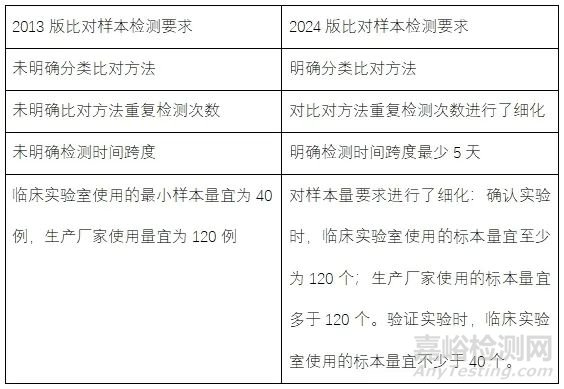
三、扩展了比对方法分类以及对比对方法重复测定次数做了具体规定
新版较旧版对比对方法进行了明确分类,即分为三类:参考方法、可溯源到参考方法的方法和其它能溯源到权威标准物质的方法。便于实际操作中选取合适的比对方法。
新版根据检测方法和比对方法的不精密度将比对方法的重复检测次数进行了详细分类:检测方法采用单次测定;比对方法可进行重复测定,以减小其不精密度对分析总误差的影响。重复测定的次数取决于检测方法和比对方法不精密度的比值(可在正常和异常浓度求其变异系数(CV)的平均值),当比值>3时,比对方法单次测量即可;当比值在1.75~3之间时,比对方法进行2~3次重复测量;当比值<1.75时,比对方法的重复测量次数应>3次。计算公式为:比对方法重复测量次数=9/(检测方法和比对方法变异系数(CV)的比值)2,按四舍五入取整数。
此外,新版对检测方法涉及的检测时间跨度明确要最少5天,此处旧版没有明确要求分不同批进行检测。新版还建议检测方法宜采用多个批号的试剂、多台分析仪和多个批号的校准品;对于受分析前因素影响较多的方法(例如POCT)还应该纳入不同操作者、检测地点和校准周期等因素。
四、对比对样本数量及浓度要求
旧版建议临床实验室使用的最小样本量宜为40例,生产厂家使用量宜为120例。新版此处按照确认或验证实验进行了分类:用于分析总误差的确认时,临床实验室使用的标本量宜至少为120个;生产厂家使用的标本量宜多于120个。用于分析总误差的验证时,临床实验室使用的标本量宜不少于40个。
因此我们在进行评估时还要注意该评估是确认实验还是验证实验。最后新版中考虑到比对样本可能需要人为调制浓度,为了获得适当的浓度,可将2个同类型疾病患者标本进行混合;为了获得低或高浓度标本,可以对标本进行稀释或添加被测物,但经过混合、稀释或添加被测物的标本数量应少于总量的20%,同时应该进行互换性评估。
以上就是WS/T 409《临床定量检测方法分析总误差的评估》新旧版本对比主要不同点的介绍。总结起来,结合医学实验室体外诊断检测以及相应的质量控制发展,新版较旧版对于分析总误差评估中的比对样本数量、检测次数、检测时间跨度(批次)进行了明确或细化,对数据统计分析进行了精简,最终目的是使评估更加专业化、规范化,更加便于实际操作。
参考资料:
1.WS/T 409-2013《临床检测方法总分析误差的确定》
2.WS/T 409-2024《临床定量检测方法分析总误差的评估》

来源:Internet


