您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-03-13 08:36
摘要
目的 通过阐述冻干注射剂辅料选择的基本考虑,为药学开发提供借鉴和思考。方法 汇总了近年来 FDA 已上市化药冻干注射剂的辅料使用情况,包括辅料组成、FDA 收载的最大辅料用量等,论述冻干注射剂辅料选择需重点考虑的问题。结果 已上市冻干注射剂中有四分之一不使用辅料,而使用最多的辅料类别分别是冻干赋形剂、缓冲盐和 pH 调节剂,其他辅料包括增加溶解的辅料、抗氧剂等。结论 冻干注射剂辅料的选择要重点考虑安全性、处方合理性、功能性指标及辅料控制方面的问题。
【关键词】 冻干注射剂; 辅料; 安全性; 处方合理性; 功能性指标
冻干注射剂是指采用冷冻干燥法制备的用于注射给药的制剂。冻干工艺适合于热不稳定原料药,有些原料药因自身溶解性、剂量以及冻干成型性问题,需使用辅料以改善冻干产品的功能特性和稳定性。
1.已上市冻干注射剂辅料使用情况汇总
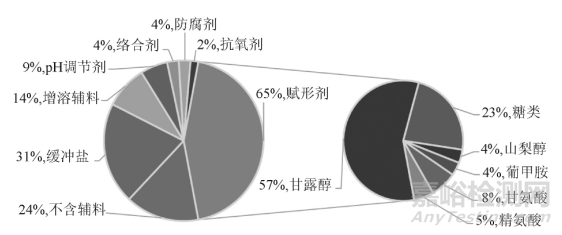
从 2009 年至 2019 年( 统计截止至7月) ,美国食品药品监督管理局( Food and Drug Administration,FDA) 上市批准新药 385 款,其中新分子实体新药280 款,化药冻干注射剂共有 23 种,见表 1。Baheti等[1]于 2010 年发表文章汇总了 2009 年之前 58 种美国已上市化药冻干注射剂的信息,见表 2。对美国已上市冻干注射剂的处方进行汇总分析,发现约24% 的制剂不添加任何辅料。使用辅料的制剂中,约 65% 的制剂使用冻干赋形剂,冻干赋形剂包括以甘露醇为代表的多元醇类、低分子糖类、少量的氨基酸类以及部分聚合物类; 缓冲盐在冻干注射剂中的使用占比约 31% ,主要包括枸橼酸、酒石酸、磷酸、琥珀酸及其盐类等; 此外冻干制剂中还包括增加溶解度的辅料( 羟丙基-β-环糊精、聚山梨酯 80 等) 、pH 调节剂( 氢氧化钠、盐酸) 、络合剂[乙二胺四乙酸( EDTA) 及盐等]、防腐剂( 苯甲醇和羟苯甲酯) 以及抗氧剂( 生育酚) 等辅料。FDA 已上市冻干注射剂中各类辅料在制剂中的使用比例见图 1。
▲表 1-2009 年至 2019 年 7 月 FDA 上市化药类冻干注射剂
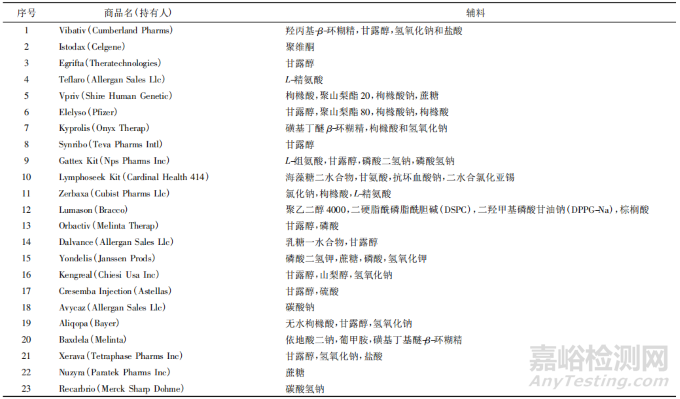
▲表 2-2009 年前 USA 已上市化药冻干注射剂
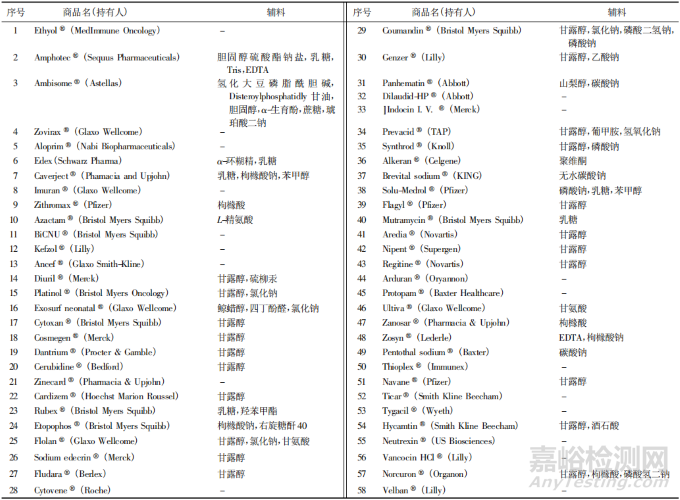
▲图1-已上市冻干注射剂中辅料的使用情况
2.常用辅料的用量情况
FDA IID( Inactive Ingredient Database) 收载了不同给药途径下辅料单剂量最大用量,其中注射剂中常用各类辅料的用量及用药途径信息汇总见表 3。数据库中不同剂型的计量单位不同,冻干注射剂辅料单剂量最大用量以 3 种方式表述,即% w /v( 冻干粉末辅料用量通常以复溶后产品中辅料的百分比) 、% ( 重量百分比) 或者 mg( 重量) 表示[2]。IID数据库仅提供单剂量制剂辅料的最大用量,每日给药剂量、用药周期、用药人群信息均未提供,因此无法推断辅料每日最大用量情况。尽管如此,IID收载数据仍可为辅料用量确定提供支持性依据。
▲表3-FDA IID 收载冻干注射剂常用辅料注射途径最大用量情况
3.冻干注射剂中的辅料类别
《美国药典》按功能将辅料分为 45 类,其中与冻干注射剂相关的辅料包括 Buffering Agent( 缓冲盐) 、Bulking Agent for Freeze-Drying( 冻干赋形剂) 、Complexing Agent( 络合剂) 、Tonicity Agent( 渗透压调节剂) 、Wetting and /or Solubilizing Agent( 润湿和/或增溶剂) 等。对冻干注射剂常用辅料类型简单介绍如下。
3. 1 冻干赋形剂
冻干赋形剂主要起到支持冻干药饼结构的作用。良好的药饼结构能够保证冻干过程中溶剂顺利逸出,药饼结构坍塌会增加溶剂挥发阻力,导致局部溶剂残留增加。如果溶剂为水,那么局部水分过高可能会导致活性药物成分的降解。一些总固体含量小于 2%的小规格药物冻干过程需要冻干赋形剂支撑[3]。原料药冻干成形性良好,大规格制剂不需要辅料即可冻干。甘露醇是化药冻干注射剂中最常用的赋形剂,其他常用赋形剂依次为糖类( 如乳糖、蔗糖) 、氨基酸类( 如甘氨酸、精氨酸) 和聚合物类( 如聚维酮和聚乙二醇) 等。冻干赋形剂可能为结晶型或非结晶型。甘露醇常见为结晶型,包括 α,β 和 δ3 种晶型[4],但当甘露醇形成过饱和溶液时,也会形成无定形态[5-6]。非结晶型冻干赋形剂主要包括糖类和氨基酸类,例如海藻糖、乳糖、精氨酸、甘氨酸、赖氨酸等[7]。
3. 2 缓冲盐
添加缓冲盐的目的是为了控制药液的 pH 值,常用的缓冲盐包括枸橼酸、酒石酸、磷酸及其盐等。对 pH 敏感药物控制溶液 pH 可防止药物在配液、复溶和储存过程中降解。缓冲盐选择需要慎重,比如磷酸钠在冷冻过程中可能会结晶析出,pH 发生偏移[8]。缓冲盐用量的确定不完全取决于药物在溶液中最稳定的 pH 条 件,有时候在溶液中稳定的pH,在冻干制剂中不一定最稳定。如 莫 西 普 利( moexipril) 在水溶液和冻干制剂中 pH 分别为 2 和8 左右水解程度最低,磺胺在 pH 3. 4 ~ 6. 0 条件下冻干粉的酸化程度始终高于溶液[9-10]。
3. 3 增加药物溶解度的辅料
这类辅料的主要作用是增加原料药的溶解度,根据发挥增溶作用机制分为表面活性剂、有机共溶剂和包合物等。表面活性剂通过形成胶束增加水不溶性药物的溶解度。注射剂常用的表面活性剂是聚山梨酯 80,其冻干的玻璃化转变温度低,因此不建议大量添加。可以将表面活性剂加入专用溶剂中用于冻干粉的复溶,以避免对冻干过程的影响,如聚山梨酯 80 浓度增加也会增加甘露醇 δ 晶 型 的 比例[11]。增加药物溶解度的另一个方法是采用水和有机溶剂的共溶剂。与水相比,有机溶剂共溶剂可以加快药物的溶解,且低沸点有机溶剂可以提高冻干效率,还可以增强溶液的无菌保证水平[12]。使用共溶剂时可能需要特殊的工艺步骤和设备,并需要对制剂中残留溶剂进行控制。最常用的共溶剂是叔丁醇-水组合,在冷冻过程中过饱和度和成核度增加,结晶速率更快[13]。另外,也可以采用其他增溶剂来增加药物溶解度,最常见的是环糊精类辅料。环糊精类将适当大小的药物分子包裹在空穴内部,可以增加水溶性差药物的溶解性[14]。经过改性修饰的环糊精具有更好的水溶性,如羟丙基-β-环糊精作为增溶剂已经用于注射途径给药[15]。
以上辅料类型是化药冻干注射剂中较为常见的三类辅料,其他类型的辅料还包括 pH 调节剂、抗氧剂、络合剂、防腐剂等,根据制剂本身特性及临床使用要求选择。
4.辅料选择的考虑
结合实际工作中遇到的一些共性问题,冻干注射剂辅料选择需要重点关注以下方面。
4. 1 安全性
冻干注射剂中的辅料必须符合注射用要求,在满足制剂需要的前提下,辅料的种类及用量应尽可能少,并且应尽可能采用注射剂常用辅料。FDA IID数据库和国家监局药品审评辅料数据库,可以查阅常用冻干注射剂的辅料使用情况,如最大用量、使用途径等。对于已有注射使用历史的辅料,若拟定辅料用量可能超出相应给药途径的历史最大使用量,应提供相关安全性数据等资料[16]。
目前《中国药典》中收载的注射用辅料非常有限。评估辅料是否满足注射要求,首先关注所选辅料在注射途径的使用经验和历史( 包括辅料种类和用量) 。其次,应对微生物负荷和内毒素进行适当控制。最后,还需要考虑辅料用于注射途径是否存在其他安全性风险,如过敏性问题、与其他药物在体内相互作用问题等。申请人需要结合适应证、用法用量、用药周期等,从临床风险获益比的角度全面评价该辅料的安全性,并应采取适当的措施降低由辅料引入的安全性风险。
以聚维酮( povidone,PVP) 为例,从安全性角度分析其用于注射剂的考虑。PVP 是 N-乙烯基酰胺类聚合物,早期静脉注射 PVP 可用作代血浆。不同相对分子质量 PVP 静脉注射后,其在体内的蓄积情况也不相同,蓄积的主要风险是影响凝血功能。相对分子质量在 110 000 ~120 000 之间,PVP 在体内会蓄积很长时间,低于 40 000 相对分子质量的 PVP 几天内清除完全,用于代血浆的 PVP 相对分子质量一般在25 000 ~40 000[17]。FDA 于 1978 年颁布联邦公报( 43Federal Register,第 14 743 页) 对申请上市用于休克用代血浆的 PVP 注射液实行撤市,并且声明任何与该产品相关或者类似的用于静脉注射的产品都不批准。撤市的 PVP 注射液是一种含 3. 5% PVP 的生理盐水注射液[18]。3. 5% PVP 注射液作为代血浆大量静脉注射存在较大的安全风险,这可能与 PVP 用量以及 PVP 型号( 相对分子质量) 密切相关。但不能一概而论认为所有 PVP 均不能用于注射给药,应结合产品适应证、给药途径、PVP 型号以及用量综合评估。目前 FDA 批准的 ISTODAX 图片和 ALKERAN 图片及其仿制制剂均使用了 PVP K12 作为冻干赋形剂,ISTODAX 用于治疗外周 T 细胞淋巴瘤,ALKERAN 用于治疗多发性骨髓瘤。FDA IID 数据库收载 PVP 注射途径其安全用量最大剂量为每支 20 mg 或者 0. 5%。
另外一个辅料安全性的例子就是聚山梨酯 80。聚山梨酯 80 具有增加药物进入大脑的潜在作用,如使用聚山梨酯 80 作为辅料需关注主药通过血脑屏障的风险。其次,聚山梨酯 80 在静脉给药后可能发生过敏性休克,过敏患者应避免使用含聚山梨酯 80的药物。此外,聚山梨酯 80 静脉给药后出现心血管方面副作用,这可能与输注速率相关,可采用较慢输注速度来降低风险[19]。
4. 2 处方的合理性
一方面,关注辅料对产品质量的影响。通过原辅料相容性研究确定处方中各辅料用量、配比的合理性,同时关注稳定性放置期间出现的质量变化,如结构坍塌、复溶时间延长以及杂质超限等,进而从处方设计、工艺控制、包材相容性等方面进行分析,确定影响产品质量的原因并加以控制。例如,甲强龙琥珀酸钠采用甘露醇作为冻干赋形剂药物水解率高于乳糖,原因可能是甘露醇和乳糖冻干后药饼微环境内含水量不同[20]。另一方面,应关注辅料对产品工艺过程及冻干程序的影响。冻干制剂中辅料种类及比例不同,共晶熔化温度( Teu ) 或玻璃态转变温度( Tg ) 也有所不同,则冻干程序温度和时间不同。预冻温度需保持在 Teu或 Tg以下,干燥温度不宜高于Teu或 Tg,以避免引起药饼结构坍塌[21-22]。但也有研究表明,干燥温度适当高于 Tg也不会引起药饼宏观结构的坍塌[23]。
对于仿制冻干注射剂,需要保证与原研制剂处方的 Q1 /Q2 一致,部分 pH 调节剂、抗氧剂以及抑菌剂如与原研不同,应阐述与原研不同的理由,并研究证明辅料变化不影响产品的安全性和有效性[24]。
4. 3 功能性指标
功能性指标用于评价辅料在制剂中的功能。例如,晶型是赋形剂最重要的功能性指标,易于结晶的赋形剂有助于保持初级干燥过程中形成的药饼结构完整性,从而防止药饼结构塌陷,无定型的赋形剂达到一定浓度,也能够防止结构坍塌。赋形剂的水分保留和吸附能力也是其重要的功能性指标,水分残留高低影响制剂的稳定性。也有研究表明,不同赋形剂的哈密特酸度( Hammett acidity) 不同,导致药物降解程度不同[25]。
4. 4 辅料控制方面
要掌握影响制剂性能的关键辅料生产工艺和质量控制情况。对于关键辅料,建议评估不同批次及不同生产商辅料对制剂质量及生产工艺的影响,根据自身开发药品的特性制定合理的内控标准,特别是功能性指标,必要时需要在申报资料中明确辅料的商品名和商业级别。
5.展 望
用于注射途径的辅料,其安全性是首先要考虑的,其次是处方中辅料使用的合理性以及辅料功能性指标的考察。最后,对关键辅料应制定适当的内控标准。建议冻干注射剂处方开发,应该从单独的原料药开始,根据原料药特性以及工艺需要逐渐增加辅料的使用。在处方开发过程中不断积累数据,为后续产品的放大及工艺变更提供了充足的知识支撑。现在原辅料实行备案登记制度,申请人应当根据自身制剂的特点,合理控制并选择辅料。
参考文献
[1] BAHETI A,KUMAR L,BANSAL A K. Excipients used in lyophilization of small molecules[J]. J Excip Food Chem,2016,1( 1) : 1135.
[2] FDA. Using the Inactive Ingredient Database Guidance for Industry. [EB /OL]. [2019-07]. https: / /www. fda. gov /regulatory information /search-fda-guidance-documents/using-inactive-ingre dient-database-guidance-industry.
[3] JENNINGS T A. Effect of formulation on lyophilization,part 1[J]. IVD Technol Mag,1997,3( 2) : 42-49.
[4] FRANKS F,AUFFRET T. Freeze-Drying of Pharmaceuticals and Biopharmaceuticals[M]. Cambridge: RSC Publishing,2007.
[5] SEARLES J A. Freezing and annealing phenomena in lyophilization,in: L. Rey,J. C. May ( Eds. ) ,Freeze-Drying /Lyophilization of Pharmaceutical and Biological Products[M]. NewYork: Marcel Dekker,Inc. ,2004.
[6] JENNINGS T. The importance of process water,in: Lyophilization,Introduction and Basic Principles[M]. Englewood: Interpharm Press,1999.
[7] PATEL S M,PANSARE S K. Optimized ratios of amino acidsand sugars as amorphous stabilizing compounds in pharmaceuticalcompositions containing high concentrations of protein-based therapeutic agents,2017.
[8] GOMEZ G,PIKAL M J,RODRIGUEZ-HORNEDO N. Effect of initial buffer composition on pH changes during far-fromequilibri um freezing of sodium phosphate buffer solutions[J]. PharmRes,2001,18( 1) : 90-97.
[9] STRICKLEY R G,VISOR G C,LIN L H,et al. An unexpectedpH effect on the stability of moexipril lyophilized powder[J].Pharm Res,1989,36( 6) : 971-975.
[10] RAMPRAKASH G,KOUSTUV C,LARRY G,et al. Impactof freeze-drying on ionization of sulfonephthalein probe molecules in trehalose-citrate systems[J]. J Pharm Sci,2010,95( 7) : 1498-1510 .
[11] HAIKALA R,EEROLA R,TANNINEN V P,et al. Polymorphicchanges of mannitol during freeze-drying: effect of surface-activeagents[J]. PDA J Pharm Sci Technol,1997,51( 2) : 96-101.
[12] GOVINDARAJAN R,CHATTERJEE K,GATLIN L,et al. Impact of freeze-drying on ionization of sulfonephthalein probe molecules in trehalose-citrate systems[J]. J Pharm Sci,2006,95( 7) : 1498-1510.
[13] TELANG C,SURYANARAYANAN R. Crystallization of cephalothin sodium during lyophilization from tert-butyl alcohol-watercosolvent system[J]. Pharm Res,2005,22( 1) : 153-160.
[14] LOFTSSON T,BREWSTER M E. Pharmaceutical applications ofcyclodextrins. 1. Drug solubilization and stabilization [J]. JPharm Sci,1996,85( 10) : 1017-1025.
[15] GOULD S,SCOTT R C. 2-Hydroxypropyl-beta-cyclodextrin( HP
beta-CD) : atox-icologyreview[J]. Food Chem Toxicol,2005,43( 10) : 1451-1459.
[16] National Medical Products Administration. Announcement on FurtherImproving Related Issues Concerning Drug Review and Approval andSupervision Work ( Draft for Comment) [EB/OL]. [2017-12-22].
http: / /www. nmpa. gov. cn /WS04 /CL2101 /336058. html.
[17] RAVIN H A,SELIGMAN A M,FINE J. Polyvinyl pyrrolidone as a
plasma expander[J]. New Engl J Med,1952,247( 24) : 921-929.
[18]FEDERAL REGISTER,VOL. 43,NO. 68-FRIDAY,APRIL 7,
1978. [EB/OL]. [2018-11-19]. https: / /s3. amazonaws. com/ar
chives. federalregister. gov /issue _ slice /1978 /4 /7/14742-14744. pdf #
page =2.
[19] European Medicines Agency. Guideline,Information for the packageleaflet regarding polysorbates used as excipients in medicinal prod
ucts for human use. [EB/OL]. [2018-11-19] .https: / /www. ema. europa. eu /en /documents/scientific-guideline /draft-information-package-leaflet-regarding-polysorbates-used-excipients-medicinal-products-human_en. pdf.
[20] HERMAN B D,SINCLAIR B D,MILTON N,et al. The effect ofbul
king agent on the solid-state stability of freeze dried methylprednisolone
sodium succinate[J]. Pharm Res,1994,11( 10) : 1467-1473.
[21] SERIGO A,RAMBHATLA S,PIKAL M J. Heat and mass transfer
scale-up issues during freeze drying,I: atypical radiation and the
edge vial effect[J]. AAPS Pharm Sci Tech,2003,4( 2) : 114-127.
[22] LAM T,STRICKLY R G,VISOR G C. An unexpected pH effect
on stability of moexipril lyophilized powder[J]. Pharm Res,2004,6( 11) : 971-975.
[23] KASPER J C,WINTER G,FRIESS W. Recent advances and fur
ther challenges in lyophilization[J]. Eur J Pharm Biopharm,2013,
85( 2) : 162-169.
[24] The Drug Evaluation Center of National Medical Products Adminis
tration. Notice on Publicly Soliciting Opinions on Technical Require
ments for Consistency Evaluation of Listed Chemical Generic Drugs
( Injections) [EB/OL]. [2017-12-22]. http: / /www. cde. org. cn/
news. do? method = viewInfoCommon&id =314268.
[25] LU E,EWING S,GATLIN L,et al. The effect of bulking agents
on the chemical stability of acid-sensitive compounds in freeze
dried formulations: sucrose inversion study[J]. J Pharm Sci,
2009,98( 9) : 3387-3396.

来源:中国药学杂志


