您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2025-04-10 08:37
在医疗器械生物相容性ISO 10993-1:2018标准中规定,仅间接接触的气体通道器械组件需要符合ISO 18562系列标准要求。
仅间接接触的气体通道器械组件包括:麻醉机、呼吸机、呼吸管、面罩、加湿器、雾化器、呼吸气体监测仪、呼吸系统过滤器、儿科保育箱的气体通路、人工鼻、复苏器等含气路的器械或附件。
ISO 18562系列包括以下四个标准:
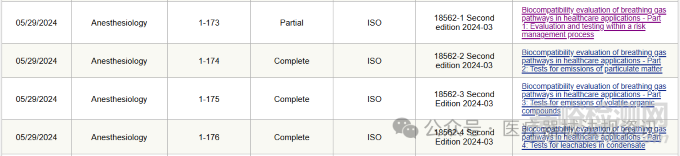
ISO 18562-1:2024:呼吸气路的生物相容性评估
Biocompatibility evaluation of breathing gas pathways in healthcare applications — Part 1: Evaluation and testing within a risk management process;
ISO 18562-2:2024: 呼吸气路颗粒物排放测试
Biocompatibility evaluation of breathing gas pathways in healthcare applications - Part 2: Tests for emissions of particulate matter;
ISO 18562-3:2024:呼吸气路挥发性有机化合物的排放测试
Biocompatibility evaluation of breathing gas pathways in healthcare applications - Part 3: Tests for emissions of volatile organic compounds;
ISO 18562-4:2024:凝结水中的可浸出物测试
Biocompatibility evaluation of breathing gas pathways in healthcare applications - Part 4: Tests for leachables in condensate。
这四个标准均于2024年3月发布,都可用于欧盟MDR认证。
美国FDA对ISO 18562-1:2024这个标准部分认可,另外三个标准全部认可。

FDA对这一系列标准的强制执行时间为2026年7月5日,也就是说,在2026年7月5日之前,FDA将接受使用符合2017年或2024年版本的ISO 18562系列标准的提交文件,在2026年7月5日之后,只接受2024年版本的ISO 18562系列标准的符合性文件。
欧盟要求2025-04-30遵守2024版本的ISO 18562系列。
FDA对ISO 18562-1:2024这个标准中不认可的条款包括:
Clause 7.2 b) 1)、Clause 7.3 b) 1)
Parenteral toxicological information may be used in the absence of inhalational toxicological information without modification.
在没有吸入毒理学信息的情况下,可以不经修改使用肠外毒理学信息。
美国FDA不认可ISO18562-1:2024标准中的这两个条款,因为它们与用于这些器械的另一个公认标准 ISO 10993-17: 2023的C.2.2.4.1 Route-to-route extrapolation的要求相冲突。
ISO 18562-1:2024 相对于ISO 18562-1:2017的主要变化
包括以下几点:
在相关监管要求中增加了信息丰富的附录;
澄清了文件中使用的术语和定义;
扩大了患者群体,包括:早产儿、幼儿、儿童和青少年;
吸入剂量的介绍;
毒理学关注的阈值发生变化;
扩大了测试的挥发性有机物的范围;
澄清了在VOS测试中使用的适当呼吸气体体积; 以及
澄清了分析中使用的适当呼吸气体体积。
2024版本的患者群体(6类) VS 2017版本的患者群体(4类):

2024版本的毒理学关注的阈值 VS 2017版本:
2017版VOC TTC要求:

For MEDICAL DEVICES intended for limited exposure use (<24 h):

For MEDICAL DEVICES intended for prolonged exposure use (>24 h but <30 d):

For MEDICAL DEVICES intended for permanent contact (≥30 d):

2024版VOS TTC要求:
For medical devices intended for limited exposure use (≤24h) and prolonged exposure use (>24h but <30d)

For medical devices intended for long-term exposure (≥30d)

2024版本的挥发性有机物的范围 VS 2017版本:
2024版本中为VOS,VOS包括VVOC、VOC和SVOC,而2017版本中为VOC。
如下为2024版本的关于VOS的测试要求。


来源:医疗器械法规资讯


