您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-25 09:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
中国首个RET抑制剂普拉替尼获批。基石药业宣布其普拉替尼胶囊上市申请已获NMPA批准,用于治疗既往接受过含铂化疗的RET融合阳性的局部晚期或转移性非小细胞肺癌。普拉替尼是一种RET抑制剂,由Blueprint公司开发(GAVRETO™),已获FDA批准用于治疗转移性RET融合阳性非小细胞肺癌的成年患者、需要系统治疗的12岁及以上晚期或转移性RET突变甲状腺髓样癌患者,以及需要系统治疗且放射性碘难治的12岁及以上晚期或转移性RET融合阳性甲状腺癌患者。普拉替尼也是中国首个获批的RET抑制剂。
国内药讯
1.全球首个未成年人组新冠疫苗临床数据公布。科兴公司日前公布了新冠病毒灭活疫苗克尔来福在3至17岁儿童中的Ⅰ/Ⅱ期临床研究结果。数据显示,克尔来福在3至17岁未成年人中不仅安全性良好,免疫原性也良好,且明显优于成人和老人;在3至11岁儿童中,低剂量疫苗即表现出良好的免疫原性,提示对儿童可选择更低剂量的疫苗开展接种。据悉,这也是目前全球首个公开的未成年人组新冠疫苗临床研究数据。
2.杨森RSV融合蛋白抑制剂拟纳入突破性治疗品种。强生旗下杨森开发的JNJ-53718678口服混悬液获CDE拟纳入突破性治疗品种,适应症为治疗儿童呼吸道合胞病毒(RSV)所致中重度呼吸道感染。JNJ-53718678是一种新型人RSV融合蛋白抑制剂,能够特异性靶向病毒表面的融合蛋白并与之结合,抑制RSV 融合蛋白介导的与宿主细胞膜的融合作用,阻止病毒进入。根据ClinicalTrials.gov信息,JNJ-53718678已登记了16项的Ⅰ期或Ⅱ期临床。
3.歌礼FASN抑制剂获FDA快速通道资格。歌礼旗下甘莱制药与Sagimet公司联合开发的FASN抑制剂TVB-2640(ASC40)获FDA快速通道资格,用于非酒精性脂肪性肝炎(NASH)适应症。值得一提的是,TVB-2640刚在本月上旬公布了一项Ⅱ期临床中国队列的积极数据。TVB-2640可显著降低患者肝脏脂肪含量28.2%(vs 11.1%),应答率达50%(患者肝脏脂肪含量降低≥30%的比例),而且ASC40组患者ALT降幅高达29.8%。该队列数据与在AASLD2020会议上发布的美国队列数据结果一致。
4.礼来偏头痛新药Ⅲ期临床中国数据积极。礼来口服5-HT1F受体激动剂Lasmiditan用于成人偏头痛急性治疗的国际Ⅲ期临床 (CENTURION)中国扩展入组研究(ME2)获得积极数据。在两个主要研究终点(首次发作用药后2小时疼痛消失,以及3次发作中至少2次疼痛消失的患者比例)和所有关键次要研究终点方面,中国人群研究数据均取得了与主研究高度一致的积极结果。Lasmiditan是FDA批准的首款5-HT1F受体激动剂,于2019年10月获FDA批准上市,用于有先兆或无先兆成人偏头痛患者的急性治疗。
5.甘李长效GLP-1激动剂申报临床。甘李药业1类创新药GZR18临床申请获NMPA受理,拟临床用于治疗II型糖尿病、肥胖及超重。GZR18为每周注射一次的GLP-1受体激动剂类药物。针对II型糖尿病,目前全球范围内已获批一周注射一次的GLP-1激动剂主要有度拉糖肽(礼来)、司美鲁肽(诺和诺德,中国处于临床阶段)和聚乙二醇洛塞那肽(豪森,仅中国获批)等。针对肥胖及超重适应症,全球尚无一周一次的GLP-1激动剂获批。
6.中国生物制药拟收购比利时药企。中国生物制药发布公告,附属公司C-Lab International Limited以1.1亿美元作价,以及与监管和商业里程碑有关的额外付款收购比利时企业Softhale的100%股权。Softhale致力于开发用于治疗呼吸道疾病的产品,其下一代软雾吸入设备(SMI)基于差异化技术,可有效提高吸入药物的肺部沉积率。中国生物制药计划利用下一代SMI技术为慢性阻塞性肺炎(COPD)和哮喘患者开发出更有效的药械合一产品,覆盖不同的COPD患者群体,补充集团现有吸入药械产品组合覆盖范围。
国际药讯
1.首创水溶性胰高血糖素类似物获FDA批准上市。FDA批准Zealand Pharma首创水溶性胰高血糖素类似物Zegalogue(dasiglucagon)注射剂上市,用于治疗6岁及以上的糖尿病患者的严重低血糖症。在一项Ⅲ期临床中,与安慰剂相比(恢复时间30~45分钟),Zegalogue给药后患者血糖的恢复速度更快,平均中位恢复时间仅为10分钟;而且成人和儿科患者两队列均达到主要终点。在另一项Ⅲ期成人试验中,99%的患者血糖在15分钟内恢复到正常水平。
2.英国NICE批准Lynparza+Avastin治疗卵巢癌。英国国家卫生保健卓越研究所(NICE)批准阿斯利康/默沙东的Lynparza(奥拉帕尼)与罗氏的Avastin(贝伐单抗)构成的组合疗法纳入英国国家卫生系统(NHS),用于对一线铂基化疗和贝伐单抗完全或部分反应的HRD阳性晚期卵巢、输卵管和腹膜癌患者的维持治疗。在一项Ⅲ期临床PAOLA-1中,这一组合较贝伐单抗将疾病进展或死亡风险降低67%,提高了患者的无进展生存期(37.2个月vs17.7个月)。
3.罗氏/再生元COVID-19抗体鸡尾酒疗法新数据积极。再生元与罗氏联合开发的新冠抗体鸡尾酒疗法REGEN-C0V(casirivimab和imdevimab)III期临床获得积极新数据。与安慰剂相比,REGEN-COV将高危非住院COVID-19患者的住院或死亡风险降低了70%;对源自南非、英国和纽约等5种主要COVID-19变种仍具有保护效力;而且,REGEN-COV在3种不同的剂量下均有效。FDA去年11月已授予REGEN-COV紧急使用授权。再生元计划向FDA申请更新其指南,纳入Ⅲ期临床中测试的最低剂量1200mg。
4.诺华靶向放射疗法达Ⅲ期临床终点。诺华 “first-in-class”靶向放射配体疗法(RLT)177Lu-PSMA-617在治疗晚期前列腺癌的Ⅲ期临床中达到双重主要终点。与最佳标准治疗相比,177Lu-PSMA-617显著改善转移性去势抵抗性前列腺癌(mCRPC)患者的总生存期(OS)和放射学无进展生存期(rPFS)。具体数据将于医学会议上公布。诺华预计今年将向美国和欧盟递交监管申请。177Lu-PSMA-617旨在将177Lu送入患者体内,通过与PSMA结合,在肿瘤局部释放辐射能量杀伤肿瘤细胞。
5.Precigen创新HPV治疗性疫苗获FDA孤儿药资格。FDA授予Precigen公司治疗性疫苗PRGN-2012孤儿药资格,用于治疗复发性呼吸道乳头状瘤(RRP)。RRP是与人乳头状瘤病毒(HPV)感染有关的呼吸系统少见肿瘤,多为良性,有一定的恶变倾向。PRGN-2012具有优化的抗原设计,它使用Precigen专有的大猩猩腺病毒载体技术,诱导针对感染HPV 6型或HPV 11型的细胞的免疫反应。该新药将与美国国家癌症研究所合作开发。
6.精准靶向免疫疗法公司Asher完成A轮融资。Asher Biotherapeutics完成5500万美元的A轮融资。Asher独有的顺式靶向(cis-targeting)技术,旨在选择性激活特定免疫细胞类型,从而在获得期望的免疫反应的同时,减少疗法的副作用。该公司的主打候选产品AB248是一款在CD8阳性T细胞中选择性激活IL-2受体信号通路的融合蛋白。在临床前实验中,AB248在大幅度激活CD8阳性T细胞的同时,几乎不激活自然杀伤细胞和Treg细胞。在多种临床前肿瘤模型中已经表现出良好的抗癌活性。
医药热点
1.全国高原适应研究康复中心正式启动运行。全国集筛查、评估、适应、治疗、康复与研究为一体的高原适应研究康复中心日前在北京正式启动运行。该中心利用首都医科大学宣武医院原研的低氧适应系列诊治技术,结合小汤山医院丰富的健康管理与康复经验,采取“1+1+2”管理模式,形成由宣武医院高原适应研究中心、小汤山医院高原适应康复中心以及拉萨市人民医院和玉树州人民医院两个前方分中心,共同组成前后方一体化诊疗体系。
2.澳门暂停接种mRNA新冠疫苗。澳门新冠病毒感染应变协调中心24日表示,澳门卫生局收到复星实业(香港)公司的书面通知,由于近期注意到多个与批号为210102的德国拜恩泰科公司生产的mRNA新冠疫苗(有效期至2021年6月)西林瓶封盖有关的包装瑕疵,拜恩泰科和复星医药已发起对该问题的原因调查,必须立即暂停接种该疫苗。应变协调中心表示,澳门引进的mRNA疫苗全部属于上述批次,即日起暂停接种。
3.香港医护人手短缺 预计2030年缺逾千名医生。香港特区政府食物及卫生局局长陈肇始24日以视像形式出席立法会卫生事务委员会时表示,香港整体医生和护士的人手短缺问题严重,预计到2030年,会欠缺1610名医生及超过3600名普通科护士。为解决医护人手短缺的问题,特区政府计划通过修例,引入非本地培训医生,增加本地医科生的学额,以及增拨额外资源予医院管理局,挽留人手。
审评动向
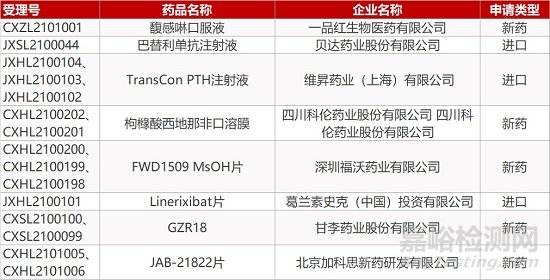
1. CDE新药受理情况(03月24日)
申请临床:
一品红的馥感啉口服液、贝达药业的巴替利单抗注射液、维昇药业的TransCon PTH注射液(3个规格)、科伦药业的枸橼酸西地那非口溶膜(2个规格)、深圳福沃的FWD1509 MsOH片(3个规格)、葛兰素的Linerixibat片、甘李药业的GZR18(2个规格)、加科思的JAB-21822片(2个规格)。
申请生产:
2. FDA新药获批情况(北美03月22日)

股市资讯
【科伦药业】子公司湖南科伦制药有限公司苹果酸舒尼替尼胶囊(肿瘤领域)获药品注册证书。
【华海药业】注射用伏立康唑(抗真菌药)获药物临床试验批准。
【君实生物】重组人源化抗PD-1单克隆抗体注射液(治疗晚期黏膜黑色素瘤)纳入突破性治疗药物程序。

来源:药研发


