您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-05-24 07:50
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:17条资讯,阅读时长约:3分钟 」
今日头条
拜耳“不限癌种”疗法在华报NDA。拜耳拉罗替尼(larotrectinib)胶囊和口服液的上市申请获CDE受理,推测申报的适应症为治疗携带NTRK融合基因的局部晚期或转移性实体瘤患者。larotrectinib是Loxo Oncology和拜耳开发的新一代口服TRK抑制剂。TRK融合癌可以出现在身体任何部位。出现NTRK基因融合的肿瘤类型包括乳腺癌、结直肠癌、肺癌、甲状腺癌等。在国内,拜耳的larotrectinib是首个申报上市的TRK抑制剂,罗氏的entrectinib、葆元生物的ROS1/Trk抑制剂AB-106、诺诚健华Trk抑制剂ICP-723等均处于II期临床阶段。
国内药讯
1.百济神州PD-1单抗治疗鼻咽癌临床积极。百济神州PD-1抗体百泽安(替雷利珠单抗)联合化疗一线治疗复发或转移性鼻咽癌的Ⅲ期RATIONALE 309研究中期分析结果积极。与单独化疗相比,百泽安联合化疗在无进展生存期(PFS)方面取得统计学意义的显著改善,且安全性结果与其已知风险相符,与化疗联用未出现新的安全性警示。目前,百泽安已获批用于治疗晚期鳞状NSCLC、经典型霍奇金淋巴瘤以及尿路上皮癌的3项适应症。
2.杨森/传奇生物CAR-T疗法临床积极。杨森制药和传奇生物联合开发的BCMA靶向CAR-T疗法ciltacabtagene autoleucel(cilta-cel)在ASCO2021上公布用于治疗复发/难治性多发性骨髓瘤(R/R MM)的多项临床研究(CARTITUDE-1和CARTITUDE-2)积极结果。其中,在接受过1-3种前期治疗的R/R MM患者(Ⅱ期临床CARTITUDE-2的A队列)中,中位随访为5.8个月时,有95%(n=20)的患者获得缓解,其中75%达到完全缓解,4例MRD可评估患者均达到MRD阴性标准。日前,cilta-cel已在欧美递交上市申请,欧盟EMA已正式受理cilta-cel的上市申请。
3.豪森「阿美替尼」Ⅲ期临床结果积极。豪森药业将在ASCO2021年会上公布第三代 EGFR-TKI 创新药阿美乐(甲磺酸阿美替尼片)一线治疗EGFR敏感突变阳性局部晚期或转移性非小细胞肺癌(NSCLC)Ⅲ期临床积极结果。与吉非替尼相比, 阿美乐一线治疗显著延长患者的无进展生存期(PFS)(中位PFS:19.3个月vs9.9 个月),显著延长患者的持续缓解时间(DoR)(中位DoR:18.1个月vs8.3 个月)。目前,该适应症的上市许可申请已获CDE纳入优先审评程序。
4.科伦HER2-ADC早期临床数据积极。科伦药业HER2-ADC创新药A166将在ASCO2021年会上公布I期临床研究数据。结果显示,A166(4.8和6.0mg/kg)在36例可评估的HER2阳性乳腺癌患者的ORR分别为59.1%和71.4%;4例可评估的HER2低表达乳腺癌患者中PR有1例,SD有2例和PD有1例。中位PFS尚未达到,当前披露数据的患者仍有59%在继续接受治疗。4.8mg/kg剂量组中1例患者接受A166治疗已超过19个月。临床中,剂量递增阶段未观察到剂量限制性毒性。
5.嘉和生物STING激动剂在华获批临床。ImmuneSensor Therapeutic与嘉和生物联合申报的STING激动剂新药IMSA101注射液获国家药监局一项临床试验默示许可。该项临床旨在评价GB492在晚期恶性肿瘤受试者中的安全性和初步有效性,并确定GB492单药以及联合PD-1/L1单抗治疗的Ⅱ期推荐给药剂量,计划入组的受试者包括但不限于黑色素瘤,三阴性乳腺癌,肝癌,头颈癌,肾细胞癌,胃食管癌等癌种。目前该新药正在美国开展用于治疗晚期恶性肿瘤的I/IIa期临床。
6.STAT5抑制剂治疗新冠在美获批临床。健艾仕生物创新STAT5抑制剂clinflamozyde获FDA批准,即将开展用于治疗新冠疾病的临床研究。在细胞和动物模型中,clinflamozyde显示出对细胞因子风暴有显著抑制作用,且不影响抗病毒的干扰素通路。依照设计,试验将评估这一具有潜在创新作用机制的分子能否通过调节STAT的功能,减少出现急性呼吸窘迫综合征患者的死亡率。
国际药讯
1.BMS的PD-1疗法在美获批辅助治疗食管癌。FDA批准百时美施贵宝(BMS)PD-1疗法Opdivo(nivolumab)扩展适应症,作为辅助疗法,用于治疗切除术后的食管癌或胃食管连接部(GEJ)癌患者。这些患者在接受过新辅助放化疗(CRT)后发现残余病理学疾病。在一项Ⅲ期临床CHECKMATE-577中,与安慰剂相比,Opdivo辅助治疗使这类患者的无病生存期延长一倍(中位DFS:22.4个月vs11.0个月)。Opdivo是首款获批辅助治疗这类患者的免疫疗法。
2.武田抗病毒创新疗法在美报NDA。FDA受理武田 “best-in-class”口服UL97蛋白激酶抑制剂maribavir(TAK-620)的新药申请(NDA),用于治疗接受器官移植或造血细胞移植后的难治性、有或无耐药性(R/R)巨细胞病毒(CMV)感染患者。在一项用于移植患者中R/R CMV感染患者的关键性Ⅲ期临床中,maribavir达到试验的主要终点,与常规抗病毒治疗相比显示出优效性。该新药此前曾获FDA授予的突破性疗法认定。
3.礼来糖尿病新药将报NDA。礼来GIP/GLP-1双重激动剂tirzepatide在治疗心血管(CV)风险增加的2型糖尿病患者的Ⅲ期临床SURPASS-4中达到主要和所有关键性次要终点。与甘精胰岛素对照组相比,三种不同剂量(5 mg,10 mg和15 mg)tirzepatide均显著降低患者的糖化血红蛋白(A1C)和体重。其中15 mg tirzepatide治疗组患者52周后有91%的患者A1C水平低于7%,有43%的患者A1C达到正常人水平,平均体重减少11.7公斤。至此,tirzepatide已在全部5项国际Ⅲ期临床中达到主要终点。该公司计划在今年晚些时候提交其上市申请。
4.默沙东15价肺炎疫苗儿科III期临床积极。默沙东15价肺炎球菌结合疫苗V114在两项III期儿科临床中达到了免疫原性和安全性的主要终点。在42-90天健康婴儿中,与接受四剂系列PCV13疫苗的受试者相比,PCV13混合剂量方案后再接种V114受试者的免疫应答结果显示,针对13种血清型或肺炎球菌疾病菌株,施打两种疫苗的效果具有可比性。使用V114用于7个月-17岁健康儿童的追加施打疫苗方案时,V114对于13种共有的血清型,该疫苗的免疫反应通常与PCV13相当。预计年底前向FDA提交用于儿童的补充上市申请。
5.罗氏PD-L1辅助治疗NSCLC的III期临床积极。罗氏将在ASCO021上公布PD-L1抑制剂Tecentriq辅助治疗早期非小细胞肺癌(NSCLC)的关键性Ⅲ期临床积极结果。早期NSCLC患者在手术切除和化疗后,与最佳支持疗法相比,Tecentriq辅助治疗将患者无病生存期(DFS)延长接近7个月,将疾病复发或死亡风险降低21%(HR=0.79,95% CI:0.64-0.96);在PD-L1>1%患者中,Tecentriq将疾病复发或死亡风险降低34%(HR=0.66,95% CI:0.50-0.88),Tecentriq组中位DFS尚未达到,而最佳支持疗法组的中位DFS为35.3个月。
6.AD创新疗法Ⅱ期临床结果积极。Annovis Bio公司开发的具有靶向多种蛋白潜力的口服脂质小分子药物ANVS401,在治疗早期阿尔茨海默病(AD)的Ⅱ期临床中获得积极结果。ANVS401治疗组25天后患者的ADAS-Cog11评分相较于基线改善了4.4点(意味着30%的改善),具统计学意义;与安慰剂组相比,ANVS401治疗组的评分改善3.3点(22%,p=0.13)。值得一提的是,ANVS401在治疗帕金森病(PD)的Ⅱ期临床中也刚刚获得积极结果,显著降低患者体内的四种与炎症相关的生物标志物。
医药热点
1.首儿所拟开展7天“云端”义诊。首都儿科研究所附属儿童医院互联网医院将于“六一”期间开展为期一周的“云端”义诊活动。5月31日至6月6日,175名专家将在线上为群众义诊。义诊涵盖呼吸内科、消化内科、神经内科、新生儿内科、普通(新生儿)外科、耳鼻咽喉头颈外科、皮肤科、保健科等23个临床科室,并增加了具有儿科特色的遗传门诊、育儿咨询门诊、药学咨询门诊和护理门诊。
2.四川限期整改医疗行业突出问题。四川省政府日前印发《四川省落实医疗卫生行业综合监管督察反馈意见整改方案的通知》。《通知》对照督察反馈的5个方面18项突出问题,明确整改措施、责任单位、整改时限。这5个方面包括:清理医疗机构冠名不合规行为,对涉医违法犯罪持续保持严打高压态势,制定四川省强化医疗机构行风治理有关规定,深入实施“信用+综合监管”试点工作,进一步加强卫生健康监督执法体系建设。
3.安徽辽宁新冠病例病毒基因序列相同。5月20日,国务院联防联控机制在京召开新闻发布会,介绍疫情防控和疫苗接种有关情况。中国疾控中心流行病学首席专家吴尊友表示,此次安徽、辽宁出现聚集性疫情的病毒是来自境外感染的人或被污染的物品;安徽和辽宁病例的病毒基因序列完全相同,显示是同一个传播链。目前溯源工作还在调查当中。
4.中国14家医药企业上福布斯全球企业2000强榜单。福布斯发布全球企业2000强榜单。该榜单主要依据销售额、利润、资产、市值这四大衡量标准对全球上市公司进行排名。中国(包括港澳台地区)共有395家企业上榜,其中医药企业有14家,分别为国药控股、上药医药、恒瑞医药、药明康德、智飞生物、石药集团、长春高新、翰森制药、药明生物、中国生物制药、广州白云山医药集团、复星医药、漳州片仔癀药业和百济神州。
审评动向
1. CDE新药受理情况(05月21日)
申请临床:
上海迪诺的注射用DN015089、百时益医药的PB2452注射液、默沙东的帕博利珠单抗注射液。
申请生产:
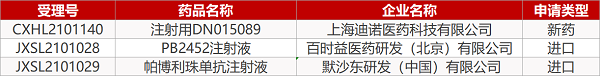
2. FDA新药获批情况(北美05月21日)
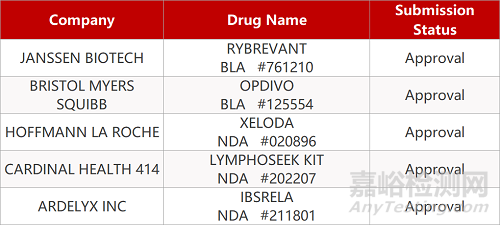

来源:药研发


