您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-10 08:27
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
科维福新冠灭活疫苗获批紧急使用。6月9日,由中国医科院生物所自主研发的科维福新冠病毒灭活疫苗首批上市供应国内紧急使用。在Ⅰ/Ⅱ期临床研究中,该疫苗显示出良好的安全性和免疫原性,接种后能快速诱导系统的免疫应答,全程免疫后14天中和抗体与抗S蛋白抗体阳转率分别达到96%与99.33%。该疫苗免疫程序与同类疫苗一致,全程接种2剂,每剂间隔2-4周。目前接种年龄为18岁及以上人群。
国内药讯
1.泽璟肝癌靶向新药国内获批上市。泽璟制药1类新药甲苯磺酸多纳非尼片获国家药监局批准上市(受理号:CXHS2000010),用于既往未接受过全身系统性治疗的不可切除肝细胞癌患者。多纳非尼是一种口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,本质为“氘代索拉非尼”。在一项II/III期临床ZGDH3中,多纳非尼治疗组中位总生存期(mOS)和安全性均优于索拉非尼对照组。目前该品种已被写入2020版原发性肝癌诊疗指南,为I级专家推荐。
2. 治疗亨廷顿舞蹈症新药即将获批。山东博士伦福瑞达制药丁苯那嗪片的进口申请(相关受理号为JXHS2000123/124)进入行政阶段,预计即将获批,成为国内第二款亨廷顿舞蹈症(HD)治疗药物。丁苯那嗪(tetrabenazine,Xenazine)是一种VMAT2抑制剂,该药最初用于治疗精神分裂症,2008年被FDA批准用于治疗HD,是首个在美国获批治疗HD的药物。在国内,丁苯那嗪已于2018年被纳入第一批临床急需境外新药。
3.上海健信PD1/TIM3双抗国内报IND。上海健信生物注射用重组抗PD1/TIM3人源化双特异抗体的临床试验申请获CDE受理,为该公司国内申报的首款药物。健信生物是一家肿瘤免疫双抗创新药研发企业,其专有的“S-body”技术平台开发了多款双抗、多抗以及ADC药物,目前均处于临床前研发不同阶段。今年5月,该公司宣布完成A轮融资以加速推进BIS5和BIS2两款双靶点产品的中美IND申报和I期临床。
4.杨森BCMA/CD3双抗国内获批临床。杨森1类生物新药teclistamab注射液获国家药监局临床试验默示许可,拟开发用于多发性骨髓瘤(MM)的治疗。这是一款BCMA/CD3双特异性抗体,此前已获FDA授予治疗多发性骨髓瘤的突破性疗法认定,并获欧洲EMA颁发的优先药物资格(PRIME)。一项公布于ASCO2021年会上的临床试验(MajesTEC-1)结果显示,中位随访超过6个月时,在可评估患者中(n=40例)的总缓解率达到65%,而且teclistamab总体耐受性良好。
5.乐普生物TF -ADC国内报IND。乐普生物旗下1类生物新药MRG004A的临床试验申请获CDE受理。MRG004A是乐普生物基于从Synaffix引进的定点偶联技术GlycoConnectTM和极性间隔技术HydraSpaceTM开发的一款TF靶向抗体偶联药物(ADC)。在临床前研究中,MRG004A已在携带Kras G12V突变的胰腺癌及卵巢癌等多个动物模型中表现出显著的抗肿瘤活性。目前,该新药正在美国开展针对TF阳性晚期或转移性实体瘤的I期研究。
国际药讯
1.辉瑞20价肺炎球菌疫苗获FDA批准上市。FDA批准辉瑞Prevnar 20(肺炎球菌20价结合疫苗)用于18岁及以上成人,预防由疫苗中20种肺炎球菌血清型引起的侵袭性疾病和肺炎。据悉,这是预防导致大多数侵袭性疾病和肺炎的20种肺炎球菌血清型结合疫苗的首次获批,包含了导致美国40%肺炎球菌疾病病例和死亡的7种血清型。
2.英国NICE支持罗氏Tecentriq治疗NSCLC。英国国家健康与临床卓越研究所(NICE)日前发布指南,推荐将罗氏PD-L1疗法Tecentriq用于单药一线治疗PD-L1阳性、转移性非小细胞肺癌(NSCLC)成人患者。在一项III期IMpower110研究中,与化疗相比,Tecentriq单药一线治疗PD-L1阳性转移性NSCLC可显著延长总生存期(OS中位数:20.2个月vs13.1个月)、显著延长疾病无进展生存期(PFS中位数:8.1个月vs5.0个月)。
3.诺华MET抑制剂治疗特定NSCLC临床积极。诺华在ASCO2021年会上公布口服MET抑制剂Tabrecta(capmatinib)治疗METex14突变、转移性非小细胞肺癌(NSCLC)的Ⅱ期临床最新数据。试验结果显示,初治患者与经治患者的中位总生存期(OS)分别为20.8个月和13.6个月,总缓解率分别为67.9%(95% CI:47.6,84.1)和40.6%(95% CI:28.9,53.1);临床中,未观察到新的安全性信号或非预期安全性结果。Tabrecta是FDA批准治疗这一患者群的首款靶向疗法。
4.Byondis公司HER2-ADC品种Ⅲ期临床积极。Byondis公司新一代HER2靶向抗体偶联药物(ADC)trastuzumab duocarmazine(SYD985)在治疗经治HER2阳性不可切除的局部晚期或转移性乳腺癌的Ⅲ期临床TULIP中获积极结果。与医生选择的疗法相比,SYD985治疗组患者的PFS达到统计学意义的显著改善。此项研究还获得了初步的积极总生存期(OS)结果。详细结果将于科学会议上分享。预计今年年底前向FDA提交生物制品许可申请(BLA)。
5.拜耳两款治疗帕金森病新药上临床。拜耳宣布,旗下BlueRock公司在Ⅰ期临床试验中,已完成将多能干细胞生成的多巴胺能神经元疗法DA01首次移植给1例帕金森病患者。同时,旗下的Asklepios公司也正在推进治疗帕金森病的基因疗法AAV-GDNF,目前正在一项Ⅰb期临床研究中招募和评估患者。在啮齿类动物和非人灵长类动物模型中使用AAV-GDNF的长期实验表明,持续表达GDNF可以促进脑神经元的再生和显著的运动恢复。
6.蓝鸟生物将重启Zynteglo的临床试验。FDA取消对蓝鸟生物基因疗法Zynteglo在输血依赖性β-地中海贫血(TDT)中的两项Ⅲ期研究的临床搁置,FDA同时批准该公司重启慢病毒基因疗法LentiGlobin的研究。今年2月,由于两例参加LentiGlobinⅠ/Ⅱ期临床HGB-206的镰刀状细胞贫血症(SCD)患者分别被诊断出罹患急性髓细胞白血病和骨髓细胞异常增生症,FDA叫停了HGB-206研究和Ⅲ期HGB-210研究,以及使用同样慢病毒载体BB305的细胞疗法Zynteglo的两项后期试验。蓝鸟生物在调查报告表示,患者出现AML的诊断“极不可能”与BB305载体有关。
医药热点
1.21个病种可申报国家临床医学研究中心。第五批国家临床医学研究中心申报工作启动。此次申报的疾病领域及临床专科包括:内分泌疾病、艾滋病、血吸虫等寄生虫病、细菌和真菌类疾病、新发突发传染病、肾病与泌尿系统疾病、出生缺陷、罕见病、骨科与运动康复、职业性尘肺、地中海贫血、中医相关的重大疫病、中医相关的免疫系统疾病、中医相关的代谢性疾病、影像医学、病理诊断、麻醉医学、重症医学、急诊、放射治疗、医学营养等21个重点病种及其技术领域。
2.2020年全国基本医保基金总收入24846亿元。国家医保局公布《2020年全国医疗保障事业发展统计公报》。数据显示,2020年全国基本医保基金总收入24846亿元,比上年增长1.7%;受疫情影响,2020年就诊量同比上年有所减少,参加职工医保人员和居民医保人员享受待遇人次均下降;2020年参加全国基本医保136131万人,参保率稳定在95%以上。另外,公报数据显示,2020年全国通过省级药品集采平台采订单总金额为9312亿元,比2019年下降601亿元。
3.WHO支持在低收入国家生产新冠疫苗。当地时间6月7日,世卫组织举行新闻发布会,世卫组织总干事谭德塞呼吁七国集团国家在6月和7月分享新冠疫苗,同时呼吁所有疫苗厂商为“新冠肺炎疫苗实施计划”提供新增疫苗产量的优先购买权,或将其今年50%的疫苗产量提供给“新冠肺炎疫苗实施计划”。两个月前非盟启动了“非洲疫苗生产合作伙伴关系”项目,世卫组织支持在当地生产新冠疫苗。
审评动向
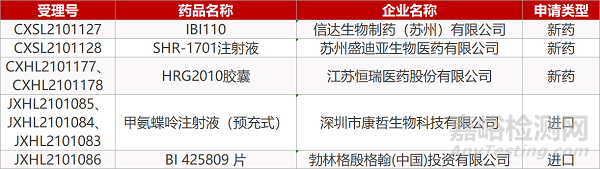
1. CDE新药受理情况(06月09日)
申请临床:
信达生物的IBI110、苏州盛迪亚的SHR-1701注射液、江苏恒瑞的HRG2010胶囊(2个规格)、深圳市康哲的甲氨蝶呤注射液(预充式)(3个规格)、勃林格殷格翰的BI 425809 片。
申请生产:
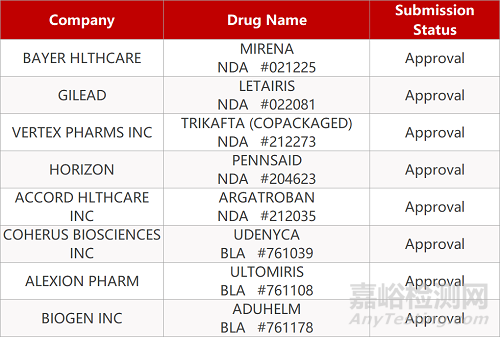
2. FDA新药获批情况(北美06月08日)

来源:药研发


