您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-01 13:28
医疗器械的验证与确认
什么是验证:
证明任何程序、生产过程、设备、物料、活动或系统确实能达到预期结果的有文件证明的一系列活动。
设备验证是用来证实设施及设备能达到设计要求及规定的技术指标,符合生产工艺要求,保证所生产出的产品达到并超过质量标准,从设备方面为产品质量提供保证。
验证目的
验证的目的:
1.规范要求;
2.提供高度的质量保证;
3.生产过程的稳定性、可靠性;
4.一种符合其预期规格和品质属性的产品。
验证的益处:
提高生产率;降低产品不合格率;减少返工;
减少生产过程中的检验工作;
减少成品的检验工作;降低客户投诉的发生;
工艺过程中出现的偏差能够迅速得到调查;
工艺生产技术能被更快转借;
生产和检验设备维修保养较为方便;
提高人员对过程的了解程度;产品质量得到有效控制。
GMP对验证的有关要求
1.企业应有验证总计划,进行药品生产验证,应根据验证对象建立验证小组,提出验证项目,制定验证方案,并组织实施。
2.药品生产验证内容应包括空气净化系统、工艺用水系统、生产工艺及其变更、设备清洗、主要原辅材料变更。
3.关键设备及无菌药品的验证内容应包括灭菌设备、药液滤过及灌封(分装)系统。
4.生产一定周期后,应进行再验证。
5.验证工作完成后应写出验证报告,由验证工作负责人审核、批准。
6.验证过程中的数据和分析内容应以文件形式归档保存,验证文件应包括验证方案、验证报告、评价和建议、批准人等。
验证的范围
环境:
受控的环境
制定不同的环境等级
关键的控制参数
温度/湿度
气流、换气次数、压差
高效过滤:微粒数量、微生物限度·清洁剂、消毒剂的效果
维护:
对关键人员的培训
清洁程序和维护的SOP,应包括:
1.规定时间间隔
2.明确的操作说明
3.文件的要求
必要的清洁维护操作
微生物的控制
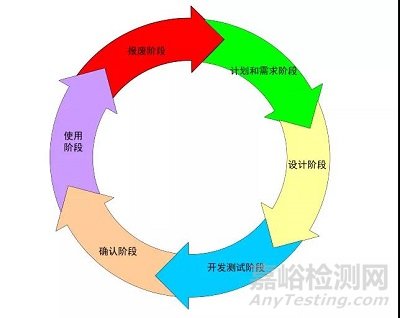
验证的生命周期
验证的方法
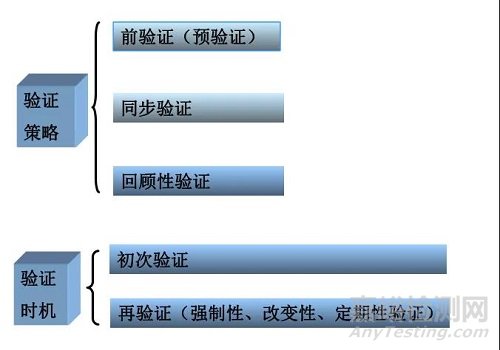
前验证定义:
正式投产前的质量活动,系指在新工艺、新产品、新处方、新设备在正式投入生产使用前,必须完成并达到设定要求的验证。
同步验证定义:
指生产中在某项工艺进行的同时进行的验证。用实际运行过程中获得的数据作为文件的依据,以此证明该工艺达到预期的要求。
回顾性验证定义:
指以历史数据的统计分析为基础,旨在证实正常生产的工艺条件适用性和可靠性的验证。

来源:Internet


