您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-02 10:47
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
石药旗下NBL-015国内报IND。石药集团旗下子公司NovaRock自主研发的抗Claudin 18.2单抗药物NBL-015的新药临床试验申请获CDE受理。在临床前研究中,NBL-015已显示出安全性好、亲和力强、抗癌活性高的特点。FDA此前已授予NBL-015用于治疗胃癌(包括食道胃结合部癌)以及胰腺癌的两项孤儿药资格。此次为该新药国内首次申报临床。
国内药讯
1.科兴新冠疫苗对少儿安全有效。《柳叶刀·传染病》发表一项针对3~17岁儿童及青少年接种科兴新冠疫苗克尔来福的I/II期临床研究结果。结果显示,接种两剂疫苗(1.5µg组和3µg组)的儿童和青少年志愿者中,中和抗体血清转化率分别为96.8%和100%,中和抗体几何平均滴度GMT分别为86.4和142.2(此前在18~59岁成人和60岁及以上老年人接种两剂3ug疫苗后GMT分别为44和42)。试验中最常见的不良反应为注射部位疼痛。
2.恒瑞复方降糖药获FDA批临床许可。恒瑞医药自主研发的HR17031注射液获FDA临床许可。HR17031注射液是由长效胰岛素与GLP-1类似物按固定比例构成的复方注射液,拟用于治疗2型糖尿病。目前已有2款同类药物被FDA和欧盟批准用于治疗2型糖尿病,分别是诺和诺德的Xultophy 100/3.6和赛诺菲的Soliqua 100/33。据统计,2020年Xultophy 100/3.6全球销售额约为3.74亿美元,Soliqua 100/33全球销售额约为1.84亿美元。
3.宜明昂科CD47xHER2双抗获批临床。宜明昂科CD47xHER2双靶点重组蛋白药物IMM2902获国家药监局临床试验默示许可,拟临床用于治疗HER2表达的晚期实体瘤。IMM2902可通过HER2的高亲和活性与肿瘤细胞结合,同时保留了不与人红细胞结合及避免了“Antigenic sink”等特点,加强了双靶点肿瘤特异性协同效应。值得一提的是,这是宜明昂科第三款基于CD47靶点的新药项目进入到临床研究阶段。
4.三叶草与Gavi签订新冠疫苗预购协议。三叶草生物宣布与全球疫苗免疫联盟 (Gavi) 签订预购协议,三叶草将提供多达4.14亿剂的重组蛋白新冠候选疫苗,通过“新冠肺炎疫苗实施计划”分配给全球参与国。三叶草生物目前正在进行新冠候选疫苗SCB-2019(CpG 1018加铝佐剂)全球关键性II/III期临床试验(SPECTRA),以评估其有效性、安全性和免疫原性。该试验预计今年年中发布中期结果。
5.艾力斯第三代EGFR-TKI海外授权。艾力斯医药自主研发的第三代EGFR-TKI甲磺酸伏美替尼(商品名:艾弗沙)与ArriVent Biopharma达成海外独家授权合作协议。根据协议,艾力斯将获得4000万美元首付款及ArriVent公司的部分股权,可高达7.65亿美元的注册和销售里程碑付款,以及产品的销售提成。ArriVent公司将获得伏美替尼在海外(除中国大陆及港澳台地区外)的独家开发及商业化许可权。
国际药讯
1.长效鼻窦炎创新疗法临床药代积极。Lyra Therapeutics非侵入性鼻窦手术替产品LYR-210在治疗慢性鼻窦炎的临床试验中获得积极药代动力学结果。研究数据表明,LYR-210具有良好安全性与耐受性,可以提供一致且稳定的给药剂量。LYR-210是一种利用生物可吸收聚合物基质包装的糠酸莫米松(MF),能够精准、持续地对鼻腔内发炎部位局部给药,一次用药治疗持续时间最长达6个月。中国联拓生物拥有LYR-210的大中华区开发权益。
2.创新口服新冠疗法Ⅱ期临床积极。Atea公司与罗氏联合开发的RNA聚合酶小分子抑制剂AT-527,在治疗轻中度COVID-19住院患者的Ⅱ期临床中获积极结果。中期结果显示,与安慰剂相比,AT-527治疗第2天时患者的病毒载量较基线水平的下降幅度更大,病毒载量下降的持续差异维持至第8天;通过RT-qPCR检测,AT-527组第14天时约47%的患者显示病毒清除,对照组这一数值为22%;临床中,未发现新的安全性问题或风险。
3.干细胞移植治疗T1D早期临床积极。ViaCyte公司干细胞来源的胰岛细胞替代疗法PEC Direct(VC-02)治疗1型糖尿病(T1D)患者获早期临床积极结果。植入PEC-Direct的首例患者第39周时C肽的最大浓度从0.1 ng/mL增加至0.8 ng/mL;而且患者第42周时的血糖水平处于目标范围内的时间比从54%增加至88%,HbA1C水平从7.4%降低至6.6%;临床中,无严重不良事件报告。详细结果将在美国糖尿病协会年会上公布。
4.全球首个MICA单抗获批临床。FDA批准Cullinan Oncology公司MICA/B靶向单抗CLN-619的新药临床研究申请(IND)。CLN-619是通过MICA/B-NKG2D 轴激活自然杀伤细胞(NK)、T细胞,进而发挥抗肿瘤活性的单抗药物,对于实体瘤和血液肿瘤均具有治疗潜力。在临床前研究中,CLN-619单药治疗的动物模型数据显示出显著的肿瘤生长抑制作用和血清可溶性MICA水平的降低。CLN-619也是首个进入人体临床试验的MICA抗体药物。
5.CXCR4抑制剂III期临床失败。PolyphorAG公司CXCR4抑制剂Balixafortide(POL6326)与艾日布林联合治疗HER2阴性、局部复发或转移性乳腺癌的全球III期研究(FORTRESS)未达到共同主要终点。在三线及以上患者(n=330)中,与艾日布林单药治疗相比,balixafortide联合艾日布林治疗的客观缓解率(ORR)没有改善(13.0%vs13.7%;p=1.00)。复星医药曾以1,500万美元首付款获得该药物中国临床开发及商业化转移性乳腺癌的独家权利。
6.RNAi联合用药治疗HBV将上临床。Antios公司RNAi疗法AB-729拟联合Antios公司的ASPIN疗法ATI-2173开展联合用药治疗慢性乙型肝炎病毒(HBV)感染的临床试验。根据两家公司达成的协议,Antios将在正在进行的一项用于治疗慢性HBV感染的随机双盲,含安慰剂对照的Ⅱa期临床试验ANTT201中,设立一个患者队列对ATI-2173、AB-729和Viread的联合用药进行评估。预计该队列将于2021年下半年启动。
医药热点
1.推进基药制度在村卫生室顺利实施。国家卫健委印发《关于做好2021年基本药物制度补助项目工作的通知》,要求各地政府办基层医疗卫生机构实施基药制度实现全覆盖,推进基本药物制度在村卫生室顺利实施。2021年,中央转移支付基药补助资金总额不变。对实施基药制度的村卫生室,转移支付资金主要用于乡村医生的收入补助,人均补助标准由8元提高至10元。
2.新一轮医保目录调整启动。国家医保局发布《2021年国家医保药品目录调整工作方案》,并于7月1日起在官方网站开通网上申报系统。今年是实施申报制的第二年,国家医保局将针对目录调整的范围、条件、程序等进一步优化完善。与前几轮目录调整相比,本次调整的范围更加科学精准,明确了目录外药品的4个申报条件,进一步突出了重点;明确了目录内和目录外药品适应症或功能主治发生重大变化的申报条件,完善了规则;明确了拟调出目录药品的重点范围。
3.四川启动特殊药品处方流转试点。特殊药品处方流转试点日前在四川省人民医院启动。试点启动后,由四川省人民医院开出的,涉及省本级和成都市门特药品的处方,其供药机构将从本院延伸到部分试点零售药店,实现供药机构更广覆盖。这种在家看病、复诊,特殊药品在线医保结算的模式,未来将在四川推广。据悉目前已有157个药品可依托“四川医保”APP或特殊药品平台实现处方信息互联互通。
审评动向
2. FDA新药获批情况(北美06月30日)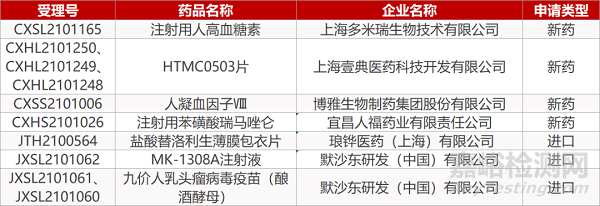
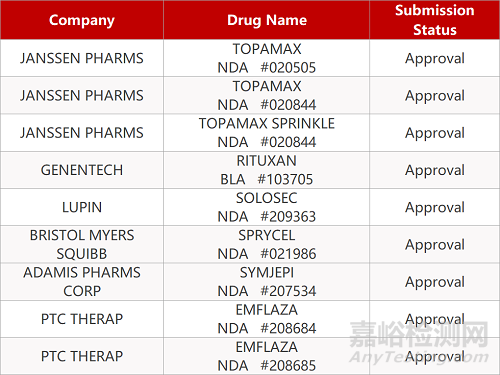

来源:药研发


