您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-20 12:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
中生制药P2X3受体拮抗剂获批临床。中国生物制药旗下泰德制药1类新药TCR1672片获国家药监局临床试验默示许可,拟临床用于治疗难治性慢性咳嗽。TCR1672是国内第二款进入临床阶段的国产P2X3受体拮抗剂,目前主要应用于治疗呼吸领域的难治性慢性咳嗽(RCC)成年患者及疼痛领域的子宫内膜异位症等复杂性内脏痛患者。今年9月,FDA受理了TCR1672的IND申请。
国内药讯
1.翰森抗真菌新药获批Ⅲ期临床。翰森制药与Scynexis公司联合开发的口服抗菌药ibrexafungerp片获国家药监局临床试验默示许可,即将在中国开展治疗外阴阴道念珠菌病(VVC)的Ⅲ期临床试验。Ibrexafungerp是一款“first-in-class”三萜类抗真菌剂,已于今年6月在美国获批用于VVC治疗,商品名为Brexafemme。翰森药业拥有该新药在大中华区开发和商业化的独家权益。
2.天境CLDN18.2/4-1BB双抗国内获批临床。天境生物双特异性抗体TJ-CD4B(ABL111)获国家药监局临床试验默示许可,拟用于实体瘤(包括胃癌、食管胃交界腺癌、食管腺癌和胰管腺癌)的治疗。TJ-CD4B是一款创新Claudin 18.2/4-1BB双抗药物,目前正在美国开展用于治疗晚期或转移性实体瘤的I期临床(NCT04900818)。此次国内获批的Ⅰ期临床将作为美国研究的剂量扩展部分开展,以全面提速TJ-CD4B的全球临床开发进程。
3.挚盟医药TLR8激动剂获批临床。挚盟医药自主研发的口服TLR8激动剂CB06-036获FDA临床试验默示许可,即将在美国开展Ⅰ期临床,评估在健康受试者中口服递增剂量后CB06-036的安全性和耐受性,以及药代动力学特性。CB06-036是一款用于治疗慢性乙肝的候选药物,已在临床前研究中显示出良好的肝靶向特征,并通过在人外周血单核细胞中诱导细胞因子,以达到多种免疫介质去激活抗病毒功能。
4.阿诺医药口服PD-L1抑制剂获批临床。阿诺医药原创新药口服小分子PD-L1抑制剂AN4005获国家药监局临床试验默示许可,即将开展一项用于治疗晚期肿瘤患者的Ⅰ期临床。临床前研究表明,AN4005具备良好的体外活性和体内抗肿瘤功效,以及良好的成药性和安全性,单药及联合用药方面具有治疗潜力。此前,阿诺医药也已向FDA提交AN4005的IND申请。
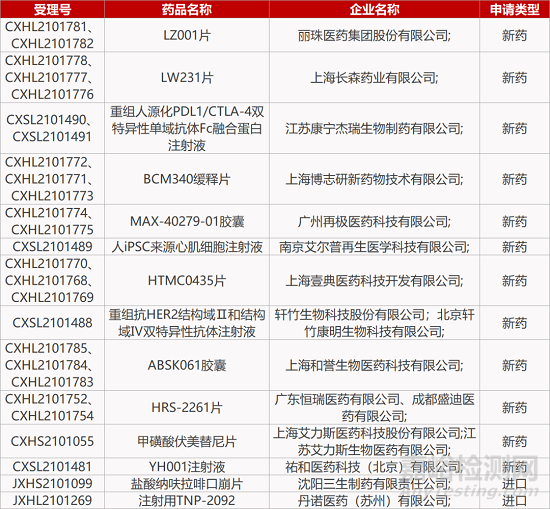
5.和誉医药FGFR2/3抑制剂报IND。和誉医药1类新药ABSK061胶囊的临床试验申请获CDE受理。ABSK061是一款高选择性FGFR2/3抑制剂,已在临床前研究「FGFR2/3依赖性异种移植模型」中显示出强靶向参与性,并能剂量依赖性地抑制多种小鼠模型的肿瘤生长。由于其对现有FGFR抑制剂(如厄达替尼及培美替尼)选择性改善,ABSK061有潜力成为第二代FGFR抑制剂。
国际药讯
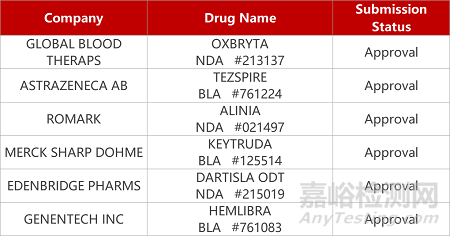
1.创新IgA肾病疗法获FDA批准上市。FDA批准Calliditas公司布地奈德(Tarpeyo)缓释胶囊上市,用于治疗有疾病快速进展风险的原发性免疫球蛋白A(IgA)肾病成人患者。布地奈德是一种皮质类固醇免疫抑制剂,是首款获FDA批准能减少IgA肾病患者蛋白尿的治疗药物。在一项Ⅲ期临床中,布地奈德较安慰剂显著降低患者的尿蛋白/肌酐比值(34%vs5%)。云顶新耀拥有该药在大中华区的开发和商业化权利。
2.礼来IL-23抗体治疗UC达Ⅲ期临床终点。礼来IL-23p19抑制剂mirikizumab治疗中重度溃疡性结肠炎(UC)患者的Ⅲ期临床LUCENT-2(NCT03524092)达到主要终点和全部关键次要终点。与安慰剂相比,mirikizumab维持治疗使患者在一年后达到临床缓解的患者比例显著更高(p<0.001);总体安全性与先前研究一致。礼来计划在明年上半年向FDA提交生物制品许可申请。
3.渤健Aβ单抗将启动确认性临床试验。渤健与卫材联合开发的阿尔茨海默病(AD)单抗疗法Aduhelm(aducanumab)预计明年开展一项大型确认性临床。这项试验拟招募超过1300例早期AD患者,大约为期4年。Aducanumab是一款β淀粉样蛋白(Aβ)靶向单抗,基于一项Ⅲ期临床中它一致地降低早期AD患者大脑中淀粉样蛋白斑块(amyloid plaque)的水平,已于今年6月获FDA加速批准上市。
4.即用型γδ-T细胞疗法早期临床积极。IN8bio公司同种异体γδ-T细胞疗法INB-100治疗曾接受过半相合造血干细胞移植(HSCT)的复发性急性髓系白血病(AML)患者的Ⅰ期临床最新结果积极。INB-100在所有3例患者中均保持缓解,前两例患者持久缓解大于1.5年;试验中未报告剂量限制性毒性,细胞因子释放综合征或免疫效应细胞相关神经毒性综合征。
5.诺华终止与Mesoblast合作开发新冠药物。诺华宣布终止与Mesoblast合作开发COVID-19药物remestemcel-L的合作交易。Remestemcel-L是一款同种异体间充质干细胞(MSC)疗法,正在III期试验中评估治疗COVID-19相关的急性呼吸窘迫综合征(ARDS)的潜力。基于今年12月的最新数据,数据安全监测委员会认为该疗法“不太可能”达到其主要终点(30天死亡率降低43%)。
6.维智基因完成B轮融资。维智基因(Verge Genomics)公司宣布完成9800万美元的B轮融资。该公司开发的“all-in-human”平台基于多种神经退行性疾病患者大脑转录组数据集,旨在通过AI“无偏倚”(unbiased)算法以发现复杂疾病的治疗靶标,开发神经退行性疾病新药。本轮融资将用于扩增公司产品管线中的临床前和临床项目的数量,并将其先导项目推进至临床试验。
医药热点
1.颜清辉任国家医保局副局长。中国政府网17日发布国务院任免国家工作人员信息,任命颜清辉为国家医疗保障局副局长。根据公开资料,颜清辉长期从事社会保险有关政策的制定和研究工作。2013年12月至2018年5月,他担任人力资源社会保障部医疗保险司副司长。此后,颜清辉担任国家医保局办公室主任,并成为国家医保局首位新闻发言人。
2.氯化镭注射液将实施零关税。经国务院批准,国务院关税税则委员会近日印发关于2022年关税调整的通知。自2022年1月1日起,我国将对954项商品实施低于最惠国税率的进口暂定税率。其中,医药类相关的包括:对新型抗癌药氯化镭注射液实施零关税,降低颅内取栓支架、人造关节等部分医疗产品的进口关税。
3.北京大学人民医院通州院区正式开诊。北京大学人民医院通州院区12月18日正式开诊。该院区位于漷县镇,建筑面积11.9万平方米,日门诊量可达4000人次,编制床位800张。作为国家创伤医学中心的通州院区,设有创伤救治中心、急诊急救中心、抢救复苏等医疗单元,还建设有用于直升机紧急救援的地面停机坪,将为冬奥会和冬残奥会的顺利举办提供最优质的医疗保障。
4.Science公布2021年度十大科学突破。12月17日,Science公布了2021年度十大科学突破评选结果。其中生物及医药领域占据7项,分别为:人工智能预测蛋白质结构、抗新冠强效药出现、迷幻药物可治疗创伤后应激障碍(PTSD)、单克隆抗体治疗传染性疾病、基因编辑工具CRISPR首次获得临床胜利、体外胚胎培养为早期发育研究打开新窗户、首次在土壤中提取到古人类DNA。
评审动态

来源:药研发


