您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-24 11:44
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
辉瑞抗新冠口服药获批上市。FDA授予辉瑞口服抗新冠病毒药物Paxlovid(利托那韦+PF-07321332)紧急使用授权(EUA),用于12岁及以上、体重不低于40公斤的轻中度新冠患者在确诊后五天内服用治疗。临床数据表明,与安慰剂相比,在COVID-19症状出现三天内接受治疗可使住院或死亡风险降低89%。这是首款获FDA授权治疗新冠疾病的口服抗病毒药物。
国内药讯
1.赛诺菲治疗房颤原研药在华获批。NMPA批准赛诺菲盐酸决奈达隆片(商品名:迈达龙)上市,用于有阵发性或持续性心房颤动病史的窦性心律患者,减少因心房颤动住院的风险。这是一款新型抗心律失常药物,在维持窦性心律和降低房颤复发方面更加有效。石药欧意开发的决奈达隆仿制药此前已于2019年10月率先在国内获批上市。
2.必贝特CDK4/6抑制剂获批Ⅲ期临床。必贝特医药CDK4/6抑制剂BEBT-209获国家药监局临床试验默示许可,拟联合氟维司群开展一项用于治疗HR+/HER2-晚期乳腺癌的Ⅲ期临床试验。该研究将由中国医学科学院肿瘤医院徐兵河院士团队领衔开展。BEBT-209的设计旨在通过降低CDK6抑制活性和提高CDK4的选择活性,减少CDK6抑制导致的血液系统和免疫抑制毒性,使药物更加安全有效。
3.来恩FIC细胞疗法获FDA快速通道资格。来恩生物“first-in-class”自体T细胞产品LioCyx-M004获FDA授予快速通道资格,用于治疗乙肝相关肝细胞癌(HCC)。这是一款利用mRNA电转技术靶向乙肝(HBV)表面抗原的TCR-T细胞疗法,已在Ⅰ期临床研究中展现出良好的安全性,并使患者生存期得到显著提升。2021年9月,该疗法的IND申请获得FDA批准,开展国际多中心Ⅰb/Ⅱ期临床研究。
4.康哲银屑病新药拟纳入优先审评。康哲药业甲氨蝶呤注射液(预充式)因符合“临床急需的短缺药品、仿制重点传染病和罕见病等疾病的创新药和改良型新药”获CDE拟纳入优先审评,用于治疗对常规疗法不敏感的严重、顽固、致残性银屑病。该新药由medac公司开发,已在欧美获批用于治疗类风湿关节炎,和多关节型幼年特发性关节炎、银屑病、银屑病关节炎、克罗恩病等自身免疫性疾病。康哲药业拥有该产品在大中华区的相关权益。
5.浙江医药CD70-ADC报IND。浙江医药子公司新码生物注射用重组人源化抗CD70单抗-AS269偶联物(ARX305)的临床试验申请获NMPA受理。ARX305是新码生物与Ambrx公司合作开发的新一代单克隆抗体偶联药物,拟用于治疗肾细胞癌、非霍奇金淋巴瘤等CD70阳性的晚期肿瘤。目前国内外尚无CD70靶向药获批上市;国内有百济神州引进的CD70单抗SEA-CD70获批临床,拟用于治疗复发/难治性骨髓增生异常综合征和急性髓系白血病。
6.鸿运华宁双靶点降糖新药报IND。鸿运华宁治疗用生物制品1类新药「重组人胰高糖素样肽1修饰抗人葡萄糖依赖性促胰岛素释放肽受体的人源化单克隆抗体注射液」的临床试验申请获CDE受理,推测应为GIPR抗体/GLP-1融合蛋白GMA106,该产品今年9月已在澳洲获批临床。目前降糖药热点转向双靶点、多靶点激动剂的开发。2021年,信立泰引进了一款GLP-1/GCGR双靶点激动剂,华东医药收购了道尔生物,还引进一款GLP-1/GIPR双靶点降糖药SCO-094。
国际药讯
1.莫德纳新冠疫苗加强针对奥密克戎有效。Moderna公布mRNA新冠疫苗mRNA-1273(elasomeran)两种剂量加强针对奥密克戎毒株(Omicron)的初步中和抗体数据。与未接种加强针相比,50µg mRNA-1273第三剂接种29天后将Omicron的中和抗体水平提高约37倍(针对Omicron的中和抗体几何平均滴度增加到850),100µg剂量加强针接种将中和抗体水平提高约83倍。该公司目前已开发Omicron特异性变体疫苗 (mRNA-1273.529),预计明年初开展临床试验。
2.诺华降脂siRNA疗法获FDA批准上市。FDA批准诺华PCSK9靶向siRNA药物Leqvio(inclisiran)上市,用于治疗成人高胆固醇血症及混合性血脂异常,降低低密度脂蛋白胆固醇(也称为“坏胆固醇”或LDL-C)。在一项Ⅲ期临床ORION中,对于使用最大耐受剂量的他汀治疗后LDL-C仍无法达标的患者,Inclisiran可使LDL-C下降达52%。值得一提的是,这款长效降脂药每年仅需皮下注射两次即可有效降低LDL-C水平。
3.阿斯利康补体C5疗法sBLA获优先审评资格。FDA受理阿斯利康开发的补体C5抑制剂Ultomiris (ravulizumab-cwvz) 用于治疗成人全身性重症肌无力(gMG)的生物制品补充许可申请,并授予其优先审评资格。在一项III期临床中,与安慰剂组相比,Ultomiris组第26周时的MG-ADL评分(日常生活能力)较基线相比获得统计学意义的改善(-3.1vs-1.4,p<0.001),并且持续至第52周;Ultomiris的安全性与在治疗阵发性夜间血红蛋白尿(PNH)和非典型溶血性尿毒综合征(aHUS) 时的安全性一致。
4.Novita公司fascin靶向抗癌新药上临床。Novita公司具“first in class”潜质的fascin蛋白抑制剂NP-G2-044在治疗晚期或转移性实体瘤的IIa期临床完成首例患者给药。该项研究旨在确定NP-G2-044单药治疗的II期推荐剂量(RP2Ds),以及当与PD-(L)1联合使用时,评估NP-G2-044的安全性、耐受性和初步抗肿瘤疗效。华润双鹤拥有该创新药在大中华区的开发、生产及商业化的独家授权。
5.诺华收购眼科基因治疗公司。诺华宣布与英国眼科基因疗法公司Gyroscope Therapeutics达成收购协议。Gyroscope的核心产品GT005是一款基于AAV2载体的一次性基因疗法,目前正在一项I/II期和两项II期临床中评估用于治疗年龄相关黄斑变性(AMD)继发性地图样萎缩的潜力。FDA此前已授予GT005快速通道资格。根据协议,诺华将支付首付款8亿美元,潜在里程金7亿美元,交易总额15亿美元。
医药热点
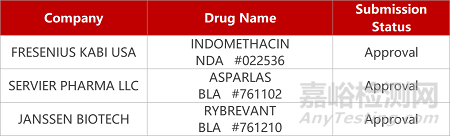
评审动态


来源:药研发


