您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-07 13:03
在实际工作中,我们经常会碰到这样真实的情况,质量部和其他部门为了要不要开启纠正预防措施,也就是我们所说的CAPA,争执的面红耳赤,不相上下,甚至要吵到公司老总那里,方能断个黑白。那么问题来了,除了我们张口说来的“系统性问题“。到底有没有什么官方的说法,可以用来给质量部撑撑腰呢?
答案是,当然有!
有道是知己知彼,百战百胜,所以我们还是先给大家普及一下CAPA的基本知识。相信大家此时都会胸有成竹的说,对于ISO13485的8.5.2和8.5.3条款,21CFR 820.100,还有国内GMP的第七十四条,在医疗器械圈子混了多年的人再熟悉不过了。那太好不过了,相信大家所在的企业都已经建立了纠正和预防措施的程序,那么请各位自己自问自答几个及格线保底问题:
问题1: 什么叫做“纠正” Correction?
问题2:什么叫做“纠正措施” Corrective Action?
问题3:什么叫做“预防措施” Preventive Action?
终极问题:发生火灾后,将大火扑灭是“纠正”还是“纠正措施”?将产生火灾的问题解决,是“预防措施”吗?
如果大家可以顺利快速的回答上面几个问题,恭喜大家,我们可以开始下面的探讨了。
我们要强调的是,企业负责人员必须首先具备相应的能力,可以判断所发生的不合格的严重度、相关风险及再发生的可能性。ISO13485:2016应用指南在谈及不合格品的处理的时候,明确的说明:如果经过判断,不合格的风险很小,或者不太可能再次发生,企业可以仅仅采取纠正措施。如果不合格再次发生,无论是发生在产品交付前,还是产品交付后,都应该采取一个或者多个纠正措施防止其再发生。
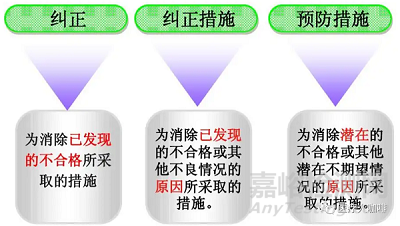
纠正Correction一般包括返修,返工或者降级使用,与消除不合格现象有关。
纠正措施Corrective Action主要是消除不合格产生的原因,简单的纠正措施包括再次搭建能力的培训,复杂的纠正措施包括制造过程的再设计等等。也就是说,纠正仅能消除产品、过程或者体系的不合格,但是此类不合格仍然可能再次发生。纠正措施可以防止同类不合格的再次发生。
需要注意的是:为了解决即时的风险或者安全问题,有必要采取初步的纠正。在完成调查并确定根本原因之后,可能需要进行其他的纠正。而纠正措施适宜解决系统性的问题。
预防措施Preventive Action则更关注防止潜在不合格的发生(也就是不让其发生),关注过程特性的趋势,风险管理也是预防措施的有效工具之一。
接下来请大家看一张图,这张图来自于GHTF CAPA指南,可以很好的帮助大家理理思路,判断不合格在在什么阶段需要进入改进阶段:
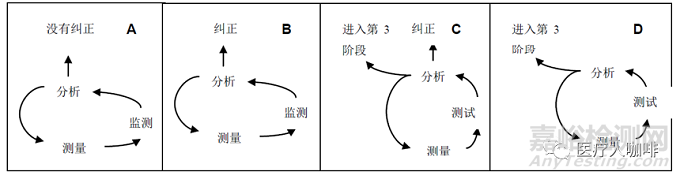
看到这张图,我们就不得不提ISO13485:2016-8.4章节“数据分析”这一条款的要求。上图的第3阶段,在此指的改进阶段,也就是“纠正预防措施阶段”。4张图都必须要基于数据分析的结果:
·A图和B图的差别在于基于数据统计和风险分析的结果,判断要不要进行纠正,可能只是一次风险很小的不合格,都不需要上升到改进阶段。
·C图表明,经过分析会采取初步的纠正,而后升级到改进阶段,根据最终的分析结果,进一步采取纠正预防措施。
·D图则表明在当下阶段,没有足够的数据或者证据来支持采取初步的纠正,需要直接上升到改进阶段,通过进一步的调查和分析,采取纠正预防措施。
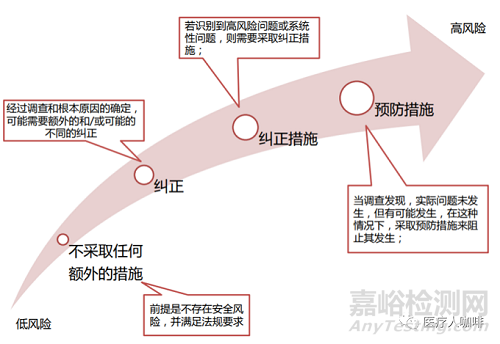
当然,我们也看到有很多集团公司,对不合格上升到纠正预防的原因和基准,做了明确的集团内部的CAPA流程,聚焦的判断基准无外乎是不合格的风险,发生频率等,这样也是一种非常好的做法,在集团公司内统一了分公司和不同职能之间的标准,很大程度上可以防止公司内的争执或者“踢皮球”行为。大家也可以借鉴。
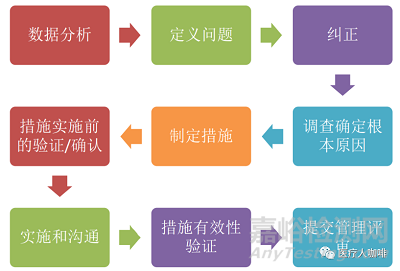
以上,是我对于CAPA这个问题的一点点想法,希望可以对大家的工作有所帮助,写得不好之处欢迎各位批评指正!

来源:医疗人咖啡


