您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-29 11:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.翰宇药业利拉鲁肽报产。翰宇药业2.2类新药利拉鲁肽注射液的上市申请获国家药监局受理。利拉鲁肽是人胰高血糖素样肽1(GLP-1)的类似物,原研产品由诺和诺德研发,目前已获批用于糖尿病(商品名Victoza)和减肥(商品名为Saxenda)等适应症。目前,全球利拉鲁肽注射液尚无仿制药获批上市。除翰宇药业外,国内共4款利拉鲁肽仿制药申报上市。
2.腾盛博药新冠中和抗体组合对BA.4/5及BA.2.12.1有效。腾盛博药新冠中和抗体联合疗法(安巴韦单抗和罗米司韦单抗)针对奥密克戎BA.4/5及BA.2.12.1亚型变异株的活病毒中和试验数据积极。在给药14天后,联合疗法的总血药浓度仍保持中和超过90%的活病毒所需浓度(Neut99: 0.94ug/mL)的170倍以上。BA.4/5及BA.2.12.1的刺突蛋白突变能有限降低抗体的中和活性,但基于联合疗法的人体药代动力学数据,预测其用于治疗新冠肺炎单次静脉注射1000mg安巴韦单抗和1000mg罗米司韦单抗后的血药浓度将保持在中和BA.4/5及BA.2.12.1所需的水平之上。
3.康威TLR7激动剂国内获批临床。康威生物自主开发的1类新药CAN1012注射液获国家药监局临床试验默示许可,拟用于晚期实体瘤。CAN1012是一款TLR7小分子激动剂,可通过刺激pDC分泌干扰素-α,并作用于其它免疫细胞(如NK细胞和巨噬细胞)发挥免疫增强的作用;它还可激活pDC,提高pDC的抗原提呈能力,促进CD4+T细胞的增殖,并进一步激活CD8+T细胞杀伤肿瘤细胞,发挥抗肿瘤作用。该新药目前正在美国开展Ⅰ期临床。
4.智康弘义ATR抑制剂获批临床。智康弘义生物研发的1类新药SC0245片获国家药品监督管理局临床默示许可,拟联合拓扑异构酶Ⅰ抑制剂(伊立替康或拓扑替康)用于治疗小细胞肺癌。SC0245是一款ATR抑制剂,ATR是ATM突变的合成致死靶点。目前全球已有多款ATR抑制剂处于临床阶段,其中默克同靶点药物Berzosertib进展最快,目前处于Ⅱ期临床。
5.海博为可透脑BTK抑制剂报IND。成都海博为药业宣布自主研发的小分子靶向创新药HBW-3-20已正式申报临床研究。HBW-3-20是海博为药业透脑创新药物开发平台开发的三代BTK抑制剂,在透脑性(大鼠透脑率:>60% VS ~10%)、有效性等方面具有优势,且能克服Tirabrutinib第一代BTK抑制剂由于C481S突变产生的耐药性问题。该药拟用于治疗B细胞非霍奇金淋巴瘤,主要开发适应症为原发性/继发性中枢神经系统淋巴瘤或可能累及中枢神经系统的弥漫大B细胞淋巴瘤(DLBCL)。
6.石药Claudin 18.2-ADC海外授权。石药集团巨石生物与Elevation Oncology就其潜在“first-in-class”的Claudin 18.2-ADC疗法SYSA1801达成合作许可协议,Elevation Oncology将获得SYSA1801在大中华地区(包括中国大陆、香港、澳门及台湾)以外地区独家开发及商业化的权益。根据协议,石药巨石生物将获得2700万美元的首付款,最多11.68亿美元的潜在里程碑付款,以及产品的销售分成。石药巨石生物将保留该产品在大中华区的所有权利。
国际药讯
1. 艾伯维JAK抑制剂治疗克罗恩病报产。艾伯维JAK抑制剂乌帕替尼(Rinvoq)分别向FDA和EMA递交了新适应症上市申请,用于治疗中重度克罗恩病。在3项Ⅲ期临床(包含U-EXCEED和U-EXCEL诱导试验,以及U-ENDURE维持试验)中,有显著较多的乌帕替尼组患者达到试验共同主要终点,即达成临床缓解与内镜缓解。乌帕替尼在3项试验中所呈现的安全性与以往一致。
2.Freeline血友病B基因疗法长期疗效积极。Freeline公司基因疗法FLT180a用于治疗血友病B的Ⅰ/Ⅱ期临床B-AMAZE研究成果发表在《新英格兰医学杂志》上。中位随访为27.2(19.1-42.4)个月时,有 90%患者(n=10)仍维持其FIX水平;患者的年度出血率从基线的每年2.93次(范围0-7.33)下降至每年0.71次(范围0-1.7);最常见与FLT180a相关的不良反应为暂时性的转氨酶升高,没有患者退出试验,亦没有FIX抑制剂产生。
3.Editas体外CRISPR基因编辑疗法上临床。Editas Medicine公司基因疗法EDIT-301在治疗严重镰状细胞贫血(SCD)的Ⅰ/Ⅱ期临床RUBY中首例患者给药。EDIT-301是一种体外基因编辑疗法,由患者来源的CD34+造血干细胞和祖细胞组成。它使用进行CRISPR基因编辑的新型Cas酶AsCas12a,对细胞编码胎儿血红蛋白的基因的启动子进行编辑,旨在为这两类患者带来一次性治愈的治疗方案。此前,该疗法已获得FDA罕见儿科疾病认定。
4.IDEAYA与安进拟评估合成致死组合疗法。IDEAYA Biosciences公司MAT2A小分子抑制剂IDE397拟与安进的PRMT5小分子抑制剂AMG 193开展联合用药I期临床,评估用于治疗MTAP-null实体瘤的安全性和有效性。MAT2A和PRMT5都是MTAP缺失肿瘤的合成致死靶标。根据双方非排他性的临床试验合作和供应协议,IDEAYA将向安进提供IDE397药物供应,安进将负责这项临床联合试验。
5.细胞因子疗法口腔癌II期临床失败。Brooklyn公司基于原代细胞衍生的多细胞因子生物免疫疗法IRX-2(含有超过29种细胞因子)与标准疗法构成的组合方案,在一线治疗II期、III期或IVA期口腔鳞状细胞癌患者的II期临床(INSPIRE)未达到2年无事件生存期(EFS)的主要终点。在意向性治疗(ITT, n=105)人群中,中位EFS为48.3个月(HR=1.10;95% CI, 0.6-2.1, p=0.62)。该方案在晚期患者和未接受化疗作为辅助治疗一部分的患者中有较好的EFS趋势。药物的总体耐受性良好,不良事件主要是注射部位反应和疲劳引起。
6.GSK 2022H1业绩公布。葛兰素史克(GSK)公布2022年上半年财报,上半年总营收141.19亿英镑,同比增长28%,其中Q2实现收入69.29亿英镑,同比增长19%。制药业务上半年专科药物收入58.39亿英镑(+69%),疫苗收入33.84亿英镑(+21%),普药收入48.96亿英镑(+3%);Q2专科药物收入27.04亿英镑(+44%),疫苗收入17.15亿英镑(+9%),普药收入25.10亿英镑(+5%)。值得一提的是,带状疱疹疫苗Shingrix上半年销售额增长超过一倍,达到14.29亿英镑。
医药热点
1.江苏拟建立罕见病用药保障机制。7月26日,《江苏省医疗保障条例(草案)》提请省十三届人大常委会第三十一次会议审议,将应保尽保、保障基本、公平适度作为基本内容,并就群众在参保、就医、待遇报销等方面重点问题作出规定,拟明确长期护理保险制度的筹资机制和功能定位,并率先提出建立罕见病用药保障机制等。《草案》指出,罕见病用药保障资金实行省级统筹、单独筹资,建立由政府主导、市场和社会慈善等参与的多渠道筹资机制;罕见病用药保障资金纳入省财政社保专户管理,专款专用,独立核算。
2.青海开建第二个省级区域医疗中心。青海省省级区域医疗中心(玉树州)建设项目开工奠基仪式在玉树藏族自治州人民医院举行。该项目总投资两亿元,建筑面积约2.1万平方米,是青海省第二个省级区域医疗中心建设项目。项目实施为1栋地面7层地下1层建筑,规划床位215张,拟于2024年10月建成交付。
评审动态
1. CDE新药受理情况(07月28日)
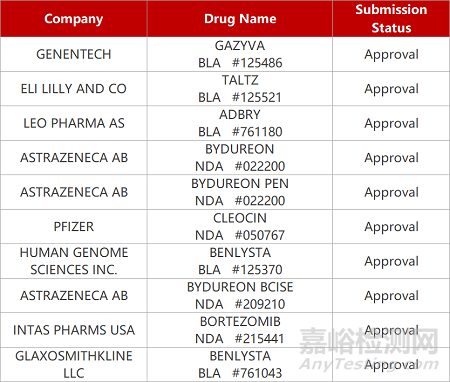
2. FDA新药获批情况(北美07月26日)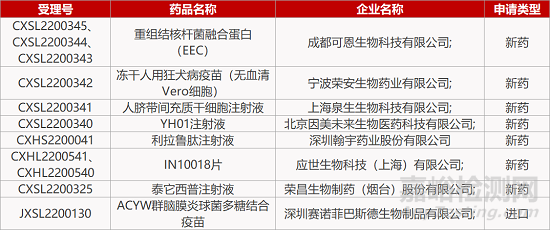

来源:药研发


