您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-15 11:23
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.辉瑞CDK4/6抑制剂在华获批上市。辉瑞开发的哌柏西利片获国家药监局批准上市,获批的适应症推测为用于HR+,HER2-局部晚期或转移性乳腺癌,应与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗。哌柏西利是辉瑞开发、全球首个获批上市的CDK4/6抑制剂,其口服胶囊制剂已于2018年7月获批进口国内,用于与芳香化酶抑制剂联用作为局部晚期或转移性HR+,HER2-绝经后女性乳腺癌患者初始内分泌治疗。
2.诺诚健华BTK抑制剂新适应症报产。诺诚健华BTK抑制剂奥布替尼新适应症上市申请获CDE受理,用于治疗复发/难治性边缘区淋巴瘤(MZL)患者。奥布替尼是诺诚健华自主研发的1类新药,此前已获批用于治疗复发/难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL),以及复发/难治性套细胞淋巴瘤(MCL)两项适应症。目前,该新药正在中美两国开展单药或联合用药的多项临床研究,涉及边缘区淋巴瘤、中枢神经系统淋巴瘤、华氏巨球蛋白血症等自免性疾病。
3.三生国健IL-17A单抗银屑病Ⅱ期临床积极。三生国健IL-17A单抗SSGJ-608在治疗中重度斑块状银屑病的Ⅱ期临床达到主要终点。第12周时,SSGJ-608各剂量组达到银屑病面积与严重程度指数改善至少75%(PASI 75)、PASI 90和皮损清除或几乎清除(sPGA 0/1)的受试者比例显著高于安慰剂组,三个剂量组分别有80.6%、89.3%、91.4%的患者同时实现PASI 90和sPGA 0/1,46.4%、48.4%和57.1%的患者达到PASI 100应答,而安慰剂组则无应答(0);第40周时,三个剂量组达到PASI 90和sPGA 0/1的患者比例维持在70%、100%、100%。SSGJ-608整体安全性良好。
4.礼来PI3Kα抑制剂报乳腺癌IND。礼来高亚型选择性PI3Kα抑制剂新药LOXO-783片的临床试验申请获CDE受理,拟用于乳腺癌的治疗。LOXO-783可穿透血脑屏障,特异靶向H1047R 突变(15%乳腺癌)。临床前研究显示,LOXO-783在乳腺癌中实现了明显的肿瘤消退,且副作用较低,不引起胰岛素和C肽的增加。目前,全球已上市的PI3Kα抑制剂有诺华的alpelisib(阿吡利塞),PI3Kα/δ抑制剂有拜耳的copanlisib。其中copanlisib已在中国申报上市。
5.中生制药2022上半年利润同比降78%。中国生物制药发布盈利预警公告,2022年上半年,由于一联营公司财务表现低于去年同期,使得集团归属于母公司持有者应占盈利较去年同期减少最多约78%至约人民币18.71亿元。但集团主营业务表现符合预期,业绩同比稳定增长。据此前披露的信息推测,联营公司应为中国生物制药持有15.03%股权的科兴中维。
国际药讯
1.重症肌无力创新疗法获批欧盟上市。argenx公司靶向新生儿Fc受体(FcRn)的抗体疗法Vyvgart(efgartigimod alfa-fcab)获欧盟委员会批准上市,用于辅助治疗抗乙酰胆碱受体(AChR)抗体阳性的全身型重症肌无力(gMG)。在国际III期临床ADAPT中,Vyvgart达到68%(vs30%,p<0.0001)的临床缓解率。FDA已于去年12月批准该新药上市,成为首款FcRn单抗。再鼎医药拥有这款创新疗法在大中华区的开发和商业化权益。
2.首款HER2-ADC获批用于NSCLC。阿斯利康联合第一三共开发的HER2-ADC新药Enhertu(trastuzumab deruxtecan)获FDA扩展适应症,用于治疗HER2突变的无法切除或转移性非小细胞肺癌(NSCLC)经治患者。这也是FDA批准治疗HER2突变NSCLC的首款药物。在一项临床试验DESTINY-Lung02中,Enhertu达到58%的确认客观缓解率(95% CI:43,71),中位缓解持续时间为8.7个月。值得一提的是,该新药一周前刚获批用于治疗无法切除或转移性HER2低表达(HER2-low)乳腺癌患者。
3.罗氏口服流感药获批用于低龄儿童。FDA批准罗氏与盐野义制药开发的单剂流感口服疗法玛巴洛沙韦(baloxavir marboxil,Xofluza)扩展适用人群,用于5-12岁儿童患者治疗急性无并发症的流感;以及用于这一群体的流感暴露后预防。与其它抗流感药物皆通过靶向神经氨酸酶来防止病毒传播的作用机制不同,玛巴洛沙韦是通过抑制流感病毒中的cap依赖型核酸内切酶,来起到抑制病毒复制的作用。
4.乳腺癌口服SERD疗法报NDA。FDA受理Menarini公司选择性雌激素受体降解剂(SERD)elacestrant(RAD1901)治疗ER+/HER2-晚期或转移性乳腺癌患者的新药上市申请(NDA),并授予其优先审评资格,PDUFA日期为2023年2月17日。在Ⅲ期临床EMERALD中,与标准治疗相比,elacestrant用于二线或三线单药显著改善总体患者的无进和展生存期PFS(PFS率:22.3%vs9.4%),显著改善ESR1突变患者的PFS(PFS率:26.8%vs8.2%),使疾病进展或死亡风险分别降低30%和45%。
5.辉瑞20vPnC婴幼儿Ⅲ期临床积极。辉瑞20价肺炎球菌偶联疫苗(20vPnC)用于预防婴儿感染侵袭性肺炎球菌疾病(IPD)的关键Ⅲ期临床结果积极。与对照组相比,接种20vPnC第四针后,受试者针对所有20种血清型的IgG抗体几何平均浓度达到非劣效性标准,而且针对14种血清型的IgG浓度达标的受试者比例也达到非劣效性标准。20vPnC疫苗的安全性与Prevnar 13疫苗相似。辉瑞计划年底递交补充生物制品许可申请(sBLA)。
6.肺结节FIC免疫疗法获FDA快速通道资格。aTyr Pharma公司FIC免疫调节剂Efzofitimod(ATYR1923)获FDA授予快速通道资格,用于治疗肺结节病。ATYR1923由组氨酰-tRNA合成酶的免疫调节结构域与人源抗体的FC段融合而成,旨在通过选择性调节神经纤毛蛋白-2(NRP2),下调炎症性疾病状态下的先天性与适应性免疫反应。该疗法已在Ib/IIa期研究中获得概念验证,目前正在III期临床EFZO-FIT开发当中。
医药热点
1.广东首家公立三甲心血管专科医院挂牌。8月10日,中国医学科学院阜外医院深圳医院三级甲等心血管专科医院揭牌仪式在深圳阜外医院举行,标志着广东省首家公立三级甲等心血管专科医院在南山诞生。据悉,阜外医院深圳医院将通过二期、三期建设,计划到2025年(医院总床位预计达到1500张),陆续打造阜外医院深圳医院科研综合楼、国际医疗部、健康生活方式医学中心等,旨在建设成一家立足深圳、服务粤港澳大湾区、辐射东南亚的国家级区域心血管医学中心。
2.上海常态核酸检测免费至9月30日。据“上海发布”,上海市全市常态化核酸检测点免费检测服务,延长至2022年9月30日。即日起至2022年9月30日,市民应每周至少进行1次核酸检测。市民如7天内无核酸检测记录,其“随申码”将会被赋黄码;完成核酸采样后,其“随申码”将在24小时内转码。对“应检未检”并造成疫情传播扩散的,将依法追究相应法律责任。
3.河南明确核酸检测结果互认。河南省近日印发《关于落实新冠病毒核酸检测结果互认的通知》,规定各地要畅通信息传输共享渠道,全省使用统一的核酸检测信息系统,保障群众通过“豫事办”及时查询核酸检测结果。严禁以本地健康码未能查询、未在本地开展核酸检测等为由拒绝通行,拒绝群众进入公共场所、乘坐公共交通工具,不得要求群众重复进行核酸检测。
评审动态
1. CDE新药受理情况(08月12日)
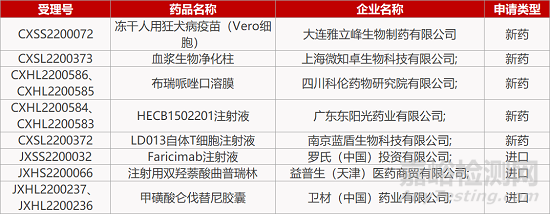
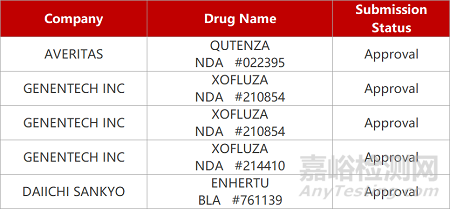

来源:药研发


