您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-17 13:50
微针(Microneedles, MNs)是指用于透皮给药、组织液采样、信号检测、生物传感和其他目标的微尺度针头,具有无痛、微创、操作方便等优点。MNs的典型长度为25~2000 μm,针尖尺寸在10~20 μm,比皮下注射针头的针尖要尖得多,以便能够轻松刺破角质层,形成微型的输送通道,而不需要接触位于表皮和皮肤层的神经纤维和血管。1976年,研究者首次提出MNs制造技术,以克服传统透皮给药的局限性。20世纪90年代以后,随着现代微细加工技术的发展,已经成功地制备出了各种各样的MNs,在生物医学领域具有广泛应用。
面对众多微针种类,想必大家可能会“眼花缭乱”,本期将按照微针特点对MNs进行分类,介绍各类MNs及其制备方法。
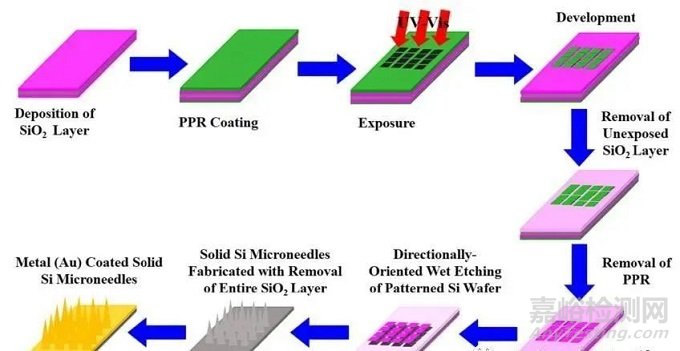
实心微针
实心微针(Solid microneedles,SMNs)是在一个平面上制造的,排列范围可从5´5到20´20,类似于一个有尖刺的板。
方法:通过激光切割和机械/化学腐蚀,可以从固体材料上直接切割出SMNs,也可由主模铸造、电镀而成。给药方式:将SMNs刺入皮肤,在皮肤表面形成微孔。去除SMNs后,使用药物贴片,药物制剂通过残留的孔隙缓慢扩散到深层组织。SMNs也可以用来划伤皮肤,在皮肤表面形成条状损伤,然后药物就会扩散到皮肤中。
优点:由于具有相对较高的硬度,SMNs具有足够的硬度,容易刺入皮肤。
缺点:硬度较高导致比较脆,SMNs在运输和使用过程中容易发生断裂。
图片来源:EngineeringForLife
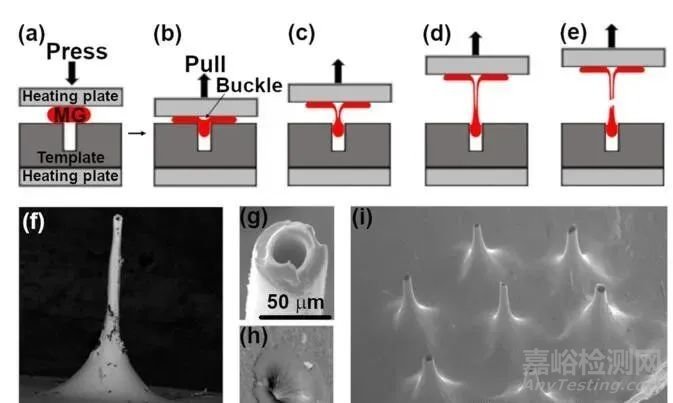
中空微针
当传统的皮下注射针在长度和直径上缩小到微米尺寸时,就成了中空微针(Hollow microneedles,HMNs)。它可以是一个单针或多个针,连接在一个板/底座上,该板/底座可以连接到一个设备,该设备提供外部驱动力,通过内部孔或腔注射液体或药物。
方法:热塑性挤压拉伸工艺等。给药方式:与皮下注射类似,液体药物可在压力驱动下通过HMNs纳米管流入皮肤。
优点:允许根据病人的需要轻松控制剂量。
缺点:由于皮肤紧致,给药率和药液体积可能受到限制。
图片来源:EngineeringForLife
涂层微针
利用各种生物可降解和生物相容性材料制备的涂层微针(Coated microneedles,CMNs),可以将高分子量的分子药物快速输送到皮肤中。将药物储存在固体相中,作为微针的涂层,可以增强其长期稳定性。
方法:浸涂、滚涂、逐层涂和喷涂等多种涂布方法。给药方式:将涂覆有水溶性药物的CMNs插入皮肤后,药物从CMNs涂层中溶解进入皮肤,然后将微针拉起。
优点:成本效益高、操作简单,能以大剂量的方式输送药物。
缺点:涂层在插入过程中易脱落,涂层在皮肤中的溶解动力学会影响药物的释放情况,但不易控制。
图片来源:EngineeringForLife
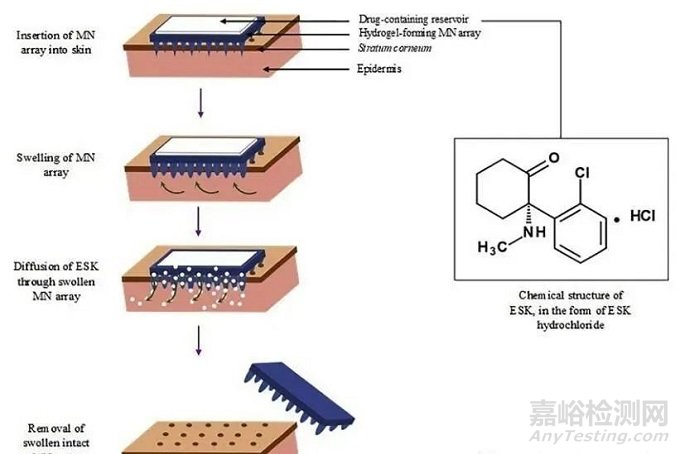
水凝胶微针
水凝胶微针(Hydrogel-forming microneedles,HFMNs)是由形成水凝胶的聚合基质制备的。这种微针阵列在插入皮肤时迅速吸收液体,导致水凝胶膨胀。这将产生连续、畅通的水凝胶导管,使药物渗透到皮肤中。
方法:利用模具法和投影式光固化(DLP)法等构建。给药方式:HFMNs在插入皮肤时迅速吸收液体,导致水凝胶膨胀,产生连续的、畅通的水凝胶导管,使药物渗透到皮肤中。
优点:a具有载药量大和可控的药物控释效果;b针体材料由高分子生物材料构成,生物相容性良好,避免了针尖断裂对皮肤造成的潜在损伤;c采用交联的高分子生物材料制备的微针可实现微针在皮下溶胀而不溶解,进而有效控制负载药物的释放速率。
缺点:因聚合物柔性问题,水凝胶微针的硬度问题尚待解决。
图片来源:EngineeringForLife
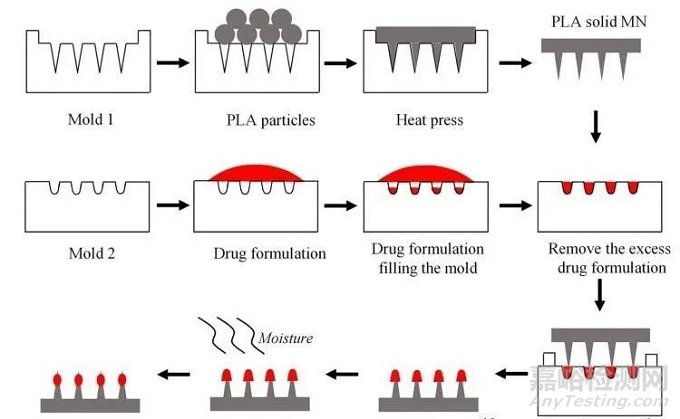
溶解微针
溶解微针(Dissolving microneedles,DMNs)是由一些生物相容性的水溶性基质材料制成的,不需要考虑是否会在皮肤上断裂和生物相容性问题。当微针插入皮肤时,针尖被组织液溶解,被包裹的药物自然释放,从而达到给药的目的。
方法:两步铸造法、液滴气吹法、离心光刻法、光聚合法、拉丝光刻法等。给药方式:生物可降解聚合物和水溶性糖类药物通常被包裹在微针基质中。DMNs插入皮肤后,会在皮肤中完全降解或溶解,从而实现药物释放。
优点:生物相容性好,给药方式简单便捷,皮肤内溶解即可,省略两步给药步骤。
缺点:药物负荷低,机械强度和皮肤穿刺能力不佳,药物活性不能很好地保持。

图片来源:EngineeringForLife
了解了微针的类型,那么我们应该如何评估所制备MNs的性能,下面整理了MNs的理化生物性能评价手段,以便于筛选合适的MNs用于后续研究。
几何形状
MNs的针尖尺寸、几何形状、针尖阵列数等因素都会影响微针的力学性能,可通过视觉检查、立体显微镜和扫描电子显微镜(SEM)等手段可视化微针的几何形状。
Aoyagi等系统探索了针尖几何形状(针尖角度、宽度)对MNs插入组织过程力学性能的影响。结果表明,具有低尖端角(15-30°)和细针轴(120 μm)的MNs可以有效地增强微针的插入,而不会导致失效。

MNs插入引起的应力分布的有限元模拟结果。(a)尖端角与应力的关系。(b)宽度与应力的关系[2]
图片来源:EngineeringForLife
微针本身的几何形状已被证明会影响插入行为。Bediz等人[3]研究表明,因锥体微针插入力随深度的增加而增加,相比之下,方尖碑设计的固体微针在更深、可重复插入方面更有效。

(a)微针的参数化几何。(b)本研究考虑的三种形状[3]
图片来源:EngineeringForLife
力学性能
皮肤的粘弹性会降低微针的穿透力,MNs必须具有足够的机械强度才能穿透皮肤。研究表明,微针进入皮肤屏障所需的插入力约为0.098 N/针,以穿透角质层。因此,将强度试验与插入试验相结合,对评价微针的穿透力具有重要意义。
评价微针机械强度最常用的试验是轴向压缩试验或微针失效试验。
测试方法:一个微针阵列连接到一个测试探针,然后将微针以预定的速度压在一个扁平的铝金属块上,直到在力-位移曲线上记录一个最大峰值。这也被称为微针的断裂力。此外,微针的脆性也可以从力-位移斜率的梯度来评估。

图4 (A) Ca2+/Alg-Mal 微针在0~1000 g抗重量范围内的形态。(B) 不同微针贴片的压缩试验
图片来源:EngineeringForLife
在每次机械压缩测试后,需对微针进行视觉直观检查,以评估微针在压缩测试过程中可能产生的任何变形(如屈曲或弯曲)。压缩试验是为了确定微针在变形前所能承受的机械强度。
插入行为
MNs必须保持完整形貌,且有效插入组织中,才能高效发挥作用,因此需对MNs进行插入研究。由于皮肤固有的粘弹性特性,整个微针长度的完整插入是很难实现的。微针插入深度分为真实深度和估计深度两类。
测定真实深度:共聚焦显微镜,X射线传输计算断层扫描、光学相干断层扫描(OCT)等。
测定估计深度:组织学切片、染色等。
药物递送
弗朗茨扩散池是研究微针增强药物真皮渗透最常用的体外方法。
原理:这些扩散池包含供体室和受体室,由膜(通常是离体的人或动物皮肤,或人工聚合物膜)隔开。含有感兴趣渗透剂的配方通常被引入供体隔室,通过所选择的膜扩散到受体隔室。随后用高效液相色谱(HPLC)等分析技术对扩散到受体室的渗透液进行分析。扩散池通常分为静态(Franz型)和流动(Bronaugh型)两种类型。
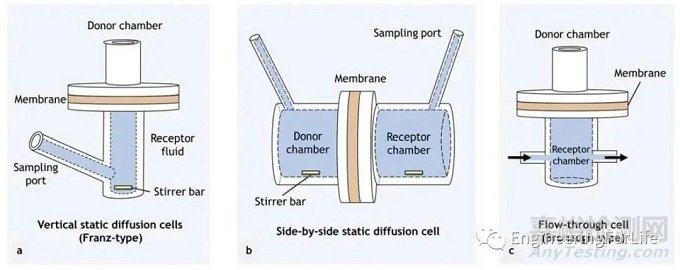
图7 用于研究皮肤渗透的扩散细胞类型。(a)垂直静态扩散池。(b)并列静态扩散池。(c)流通池
与传统的体外弗朗茨池渗透研究方法相比,微针通常先应用于皮肤,然后将供体室安装到受体室上。
通过对以上几种常见MNs性能测试表征方法及案例分析的学习,研究者可从多角度综合分析课题设计中MNs的治疗效果。

来源:Enginnering for life


