您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-22 11:41
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
信达眼科VEGF靶向双抗获批临床。信达生物自主开发的VEGF-A/VEGF-C双抗IBI333获国家药监局临床许可,适应症为新生血管性年龄相关性黄斑变性(nAMD)。这也是全球首款VEGF-A/VEGF-C双抗获批临床。临床前研究显示,IBI333可抑制镭射激光诱导的脉络膜新生血管(CNV)模型中游离VEGF-A和VEGF-C的表达,并且具有优于已上市抗VEGF药物的疗效。信达计划今年下半年启动IBI333的首次人体试验。
国内药讯
1.人福儿童罕见病首仿药「氯巴占」获批上市。宜昌人福药业氯巴占片3类仿制药获国家药监局批准上市,为国内氯巴占首款仿制药,用于治疗Lennox-Gastaut综合征(LGS)。LGS一种罕见的癫痫性脑病,在儿童期表现为顽固性癫痫发作,发病率约2/100000,属于难治性癫痫。氯巴占在中国属于《精神药品品种目录》第二类精神药品,此前曾被国家药监局纳入《第二批鼓励研发申报儿童药品清单》。
2.浙江艾森CD38靶向ADC获批临床。艾森药业1类生物制品“STI-6129注射液”获国家药监局临床许可,拟开发用于复发性/难治性多发性骨髓瘤的治疗。STI-6129是一款CD38靶向ADC药物。研究表明,CD38抗体可通过抗体依赖的细胞吞噬作用(ADCP)、抗体依赖细胞介导的细胞毒作用(ADCC)、补体依赖细胞毒作用(CDC)和通过交联作用诱导凋亡多种途径对多发性骨髓瘤细胞产生治疗效果。
3.星曜坤泽siRNA新药获批乙肝临床。苏州星曜坤泽开发的1类化药HT-101注射液获国家药监局批准临床,拟用于慢性乙型肝炎病毒感染的治疗。HT-101是一款GalNAc偶联的siRNA创新药物,主要针对乙肝表面抗原(HBsAg)的清除。临床前药效试验(AAV-HBV小鼠模型)显示,HT-101单次给药后可显著地降低HBsAg、HBeAg以及DNA水平,尤其是在降低乙肝表面抗原(S抗原)水平方面表现较好,可降低S抗原接近1000倍,且药效维持超过70天。
4.科济BCMA CAR-T产品Ⅱ期临床积极。科济药业在第七届CAR-TCR年度峰会上公布其自体BCMA CAR-T候选产品泽沃基奥仑赛注射液(zevor-cel,CT053)在北美开展的用于治疗复发/难治多发性骨髓瘤(R/R MM)的Ⅱ期临床积极结果。在可评估患者中,CT053达到100%的客观缓解率;目前中位无进展生存期、中位生存期和中位缓解持续时间尚未达到。临床中,没有出现死亡病例,以及没有患者经历过3级或者更高的细胞因子释放综合征。
5.原启GPC3靶向CAR-T获批肝癌临床。原启生物申报的靶向GPC3嵌合抗原受体自体T细胞注射液(Ori-C101注射液)获国家药监局临床试验默示许可,拟开发用于治疗晚期肝细胞癌。Ori-C101是一款靶向GPC3的CAR-T产品。公布于ASCO2021年会上由研究者发起的Ⅰ期临床结果显示,Ori-C101在GPC3阳性晚期肝癌患者中达到44%的客观缓解率(ORR)和78%的疾病控制率(DCR)。
国际药讯
1.Alnylam又一RNAi疗法获欧盟批准上市。欧盟委员会(EC)批准Alnylam公司RNAi疗法Amvuttra(vutrisiran)上市,用于3个月皮下注射一次,治疗遗传性转甲状腺素蛋白介导(hATTR)淀粉样变性成人患者的Ⅰ、Ⅱ期多发性神经病。这也是Alnylam在hATTR淀粉样变性治疗上的第二项获批RNAi疗法。在一项Ⅲ期临床HELIOS-A中,Amvuttra治疗组9个月后患者的mNIS+7评分(评估神经病障碍的评分)的改善较基线降低2.2点(vs增加14.8点,p<0.0001),有50%的患者较基线相比症状得到改善。
2.帕博利珠单抗治疗晚期NSCLC的5年数据出炉。默沙东PD-1抑制剂Keytruda(帕博利珠单抗)在ESMO2022大会上公布两项联合化疗一线治疗晚期转移性非小细胞肺癌(NSCLC)的五年随访数据(KEYNOTE-189及KEYNOTE-407)。汇总结果分析显示,与含铂化疗相比,帕博利珠单抗联合含铂化疗方案显著延长患者的总生存期(OS),鳞状NSCLC或非鳞NSCLC患者的五年OS率分别为18.4%和19.4%,化疗组这一数值分别为11.3%和9.7%。在中国,转移性肺癌的五年生存率仅有5.27%。
3.阿尔茨海默病新药Ⅱ期临床积极。Alzheon公司公布高牛磺酸(homotaurine)前体药物ALZ-801(valiltramiprosate)口服治疗早期阿尔茨海默(AD)患者的Ⅱ期临床积极结果。52周治疗数据显示,与基线相比,ALZ-801可使患者血浆P-tau181蛋白显著下降41%(p=0.032);患者的记忆评分也显著高于基线值,与所观察到的生物标志物水平与大脑影响结果相符。ALZ-801的安全性与之前结果一致。此前,该新药已获得FDA的快速通道资格。
4.湿疹新药Ⅱb临床结果积极。AOBiome公司拟用于治疗瘙痒的局部疗法B244在Ⅱb期临床中获积极结果。轻中度特应性皮炎或中重度瘙痒症患者在使用药物后的第一个小时内便出现瘙痒减缓的现象;在第14天,成人患者达到VAS评分上痒觉4分改善的比例为57.9%,儿童患者达到IMS评分上痒觉2分改善的比例为81.8%;湿疹患者的皮肤表面较基线也显著改善。试验中未观察到不良反应。AOBiome预计在2023年启动Ⅲ期试验。
5.Rocket公司引进心肌疾病基因疗法。Rocket公司宣布将收购Renovacor公司,并获得该公司拟用于治疗BAG3相关扩张型心肌病(BAG3-DCM)的潜在基因疗法REN-001。REN-001使用经过基因工程改造的AAV9载体递送表达BAG3的转基因,旨在通过在心肌细胞中表达BAG3以恢复心肌细胞的功能。在临床前研究中,它在小鼠模型中能够恢复BAG3蛋白的表达水平,并且在心脏病发作小鼠中恢复健康表型。
6.JAMA:仅75%加速批准非肿瘤适应症获得完全批准。上周发表在《美国医学会杂志》上的一项最新研究显示,1992年6月至2018年5月期间,FDA加速批准的57种非癌症适应症的48款药物,仅有75%的药物获得FDA完全批准。药物上市申请从受理到获得加速批准的中位时间为7.8个月,而将加速批准转化为常规批准的中位时间则长达53.1个月。研究人员指出,加速批准途径将非癌症药物的监管审批速度加快了近 4.5 年。然而,与安全性相关的标签变化和未经证实的临床疗效表明,对此类药物的全面评估可能需要十多年的时间。
医药热点
1.海南支持公立医疗机构试点托育服务。海南省卫健委日前制定《海南省公立医疗机构开展托育服务试点工作方案》,支持有条件的公立医疗机构创办托育机构,为职工提供福利性托育服务。要求各级公立医疗机构要将托育服务工作纳入工作重点,海口市、三亚市、儋州市、琼海市在先行试点的基础上,启动公立型婴幼儿照护服务机构建设,每个先行试点市至少建成1家以上公立型或普惠婴幼儿照护服务机构。
2.抑郁症可致罹患AD风险升高五成。复旦大学附属华山医院神经内科郁金泰教授团队联合复旦大学类脑人工智能科学与技术研究院程炜教授团队,在一项纳入30余万人群队列的研究中发现,抑郁症可增加51%的老年痴呆风险,且积极治疗抑郁症的人群发生痴呆的风险,显著低于未治疗的人群。该研究论文近日发表在《生物精神病学》杂志上。
3.郑大一附院成立“生物免疫治疗病区”。近日。郑州大学第一附属医院生物细胞治疗中心新成立的“生物免疫治疗病区”开始收治患者,将开展多项前沿免疫治疗临床试验。郑大一附院生物细胞治疗中心是集科研和临床转化应用为一体的综合性科研和临床平台,主要研究有“T细胞功能改造”、“免疫治疗技术的临床转化”和“靶向肿瘤免疫微环境增强抗肿瘤免疫治疗效果”三大方向。
评审动态
1. CDE新药受理情况(09月21)

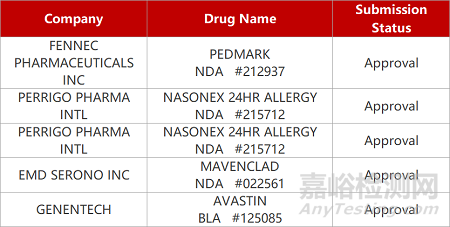

来源:药研发