您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-04 10:07
截至2022年9月30日,CDRH和CBER已授予728项突破性器械指定,包括最初根据快速访问路径(EAP)计划指定的器械。在728个器械中,CDRH授予了722个,CBER授予了6个。这728个突破性器械中,共56个获得上市,包括54个CDRH器械和2个CBER器械。
以下图表按财政年度和临床小组提供了这些指定的分布情况。
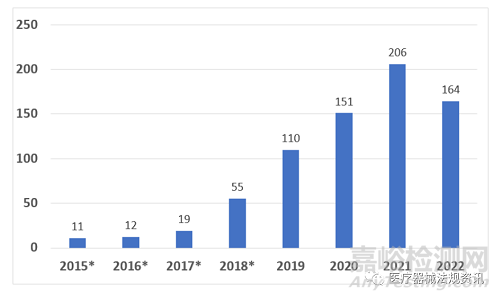
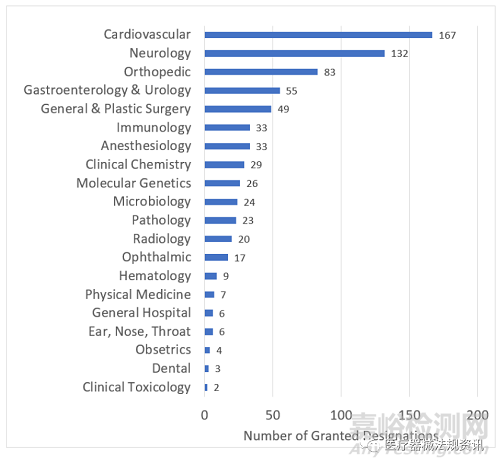
FDA目前有两则突破性器械项目的指南,其中一则是2018.12.18发布的最终指南“Breakthrough Devices Program”(以下简称2018终稿指南),另一则是近期2022.10.21发布的一则修订草案“Select Updates for the Breakthrough Devices Program Guidance: Reducing Disparities in Health and Health Care”(以下简称2022修订草稿)。
哪些产品可以申请成为FDA突破性器械?
根据2018终稿指南内容来看,符合以下两个标准的器械可以申请成为突破性器械:
器械为危及生命或不可逆转的人类疾病或病症提供了更有效的治疗或诊断;
器械至少满足以下条件之一:
1)代表突破性技术;
2)不存在已批准或cleared的备选方案;
3)与现有的已批准或cleared的替代方案相比具有显著优势;
4)器械的提供符合患者的最佳利益。
从2022修订草稿的内容来看,以下器械有望成为突破性器械:
通过在表现出健康和医疗保健差异的人群中提供更有效的治疗或诊断,以帮助解决健康和/或医疗保健差异并促进健康公平的技术和器械特征。
(健康和医疗保健的差异存在于多个层面,包括种族、族裔、社会经济地位、年龄、性别、残疾状况、性取向、性别认同、语言和地点等。)
成为突破性器械有什么好处呢?
如果您的器械被授予成为突破性器械,您可以选择与FDA互动,通过各种途径获得关于您的器械开发的反馈,包括冲刺讨论、请求讨论数据开发计划和临床方案协议的请求。
您还将获得未来监管提交的优先审查,监管提交包括Q-Submissions、研究器械豁免(IDE)申请和上市前提交(例如,PMA、510(k) 或De Novo分类请求)。

来源:医疗器械法规资讯


