您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-11-28 22:10
刚刚,江苏省药品监督管理局审评中心正式发布了《江苏省一次性使用无菌导尿管技术审评要点》,全文如下:
江苏省一次性使用无菌导尿管技术审评要点
本审评要点旨在为技术审评部门审核注册申报资料时把握重点,统一审评尺度,同时指导江苏省内注册申请人对注册申报资料的准备及撰写。本审评要点不涉及注册审批等行政事项,亦不作为法规强制执行。
本审评要点系对一次性使用无菌导尿管的一般要求,应依据产品的具体特性确定其中内容是否适用,若不适用,查看申请人是否阐述理由并提交相应的依据。本审评要点未涵盖的产品特殊性能要求,查看申请人是否依据产品特性进行了充分研究并提交相关注册申报资料。
本审评要点是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,相关内容也将适时进行调整。
一、要点适用范围
本文适用于按二类管理的一次性使用无菌导尿管(以下简称导尿管),具有特殊功能(如测温导尿管)、新型结构、含药导尿管和带抗菌涂层的导尿管等不在本文适用范围内。
二、申请表
(一)产品名称
产品名称为一次性使用无菌导尿管。
可以增加表示产品材质(如硅橡胶、乳胶等)、产品结构(如单腔、双腔、多腔球囊等)或表示涂层(如水凝胶涂层、亲水涂层)的关键词,避免使用“无痛”、“抗菌”等关键词。
(二)产品适用范围
供临床常规导尿用。如含三腔导尿管,可增加“三腔导尿管还可用于膀胱的冲洗”。
(三)规格型号
导尿管应用其公称外径(mm)表示其规格,精确到0.1mm。可同时给出其他规格标记。如2.0(6Fr)、2.7(8Fr)、3.3(10Fr)等。规格型号应与技术要求、说明书等资料中完全一致。
(四)申请人基本信息
企业名称、住所、组织机构代码等应与营业执照一致。
(五)结构组成
结构组成应与技术要求、说明书等资料中完全一致。
三、证明性文件
应有营业执照副本复印件。
四、医疗器械安全有效基本要求清单
清单表格第3列若适用,应注明“是”。不适用应注明“否”,并说明不适用的理由。
清单表格第4列应当填写证明该医疗器械符合安全有效基本要求的方法,通常可采取下列方法证明符合基本要求:
(一)符合已发布的医疗器械部门规章、规范性文件。
(二)符合医疗器械相关国家标准、行业标准、国际标准。
(三)符合普遍接受的测试方法。
(四)符合企业自定的方法。
(五)与已批准上市的同类产品的比较。
(六)临床评价。
为符合性提供的证据需标明在注册申报资料中的位置和编号。对于包含在产品注册申报资料中的文件,需说明其在申报资料中的具体位置。例如:十、注册检验报告;说明书第11章。对于未包含在产品注册申报资料中的文件,应当注明该证据文件名称及其在质量管理体系文件中的编号备查。
五、综述资料
(一)概述
一次性使用无菌导尿管的管理类别为二类,分类编码14-05。
(二)产品描述
1.产品工作原理
导尿管利用膀胱的压力使尿液通过导尿管排出体外,双腔和三腔导尿管的球囊在注入水后可以膨起,在留置导尿时用于固定导尿管。三腔导尿管还可用于膀胱的冲洗。
使用时首先润滑导尿管管身部分,将润滑后的导管小心插到膀胱(此时有尿液排出),然后再插入一定距离,使球囊完全进入膀胱。握住阀门外套,用不带针头的注射器插入单向阀内,按照产品标识的球囊容量注入额定的注射用水或0.9%氯化钠溶液,使球囊膨胀卡住膀胱。握住阀门的外套,缓慢地拔出注射器,此时单向阀自动关闭,保持球囊膨胀。取出导管时,用不带针头的空注射器插入单向阀内,抽吸球囊内的液体,当注射器中水的容量与产品标识球囊容量接近时即可缓慢地拔出导尿管。也可将管身剪断,以便快速排出球囊内液体,取出导管。
留置时间视临床需要和产品材质而定,如:乳胶导尿管一般不超过7天,硅橡胶导尿管一般不超过30天。
2.结构组成(含配合使用的附件)、主要原材料与技术要求完全一致;
3.如有区别于其他同类产品的特征应明确;
4.提供产品图示说明。
(三)型号规格
1.应当关注各型号规格的区别。
2.应当关注各种型号规格的结构组成、功能、产品特征、性能指标等方面的差异。
3.应当关注上述描述应与技术要求、说明书中完全一致。
(四)包装说明
应当关注产品包装的类型、材质等,以及与该产品一起销售的配件包装情况,以及最小包装、中包装、运输包装的信息。
(五)适用范围和禁忌症
1.适用范围:
供临床常规导尿用。如含三腔导尿管,可增加“三腔导尿管还可用于膀胱的冲洗”。
2.预期使用地点:如医疗机构、救护车等。
3.适用人群:临床需要导尿的病患。
4.禁忌症:产品材料过敏者、尿道炎症严重者禁用。
(六)其他需说明的内容
六、研究资料
(一)产品性能研究
依据:导尿管行业标准为YY 0325-2016,其它参考标准有GB/T 14233 系列标准(化学分析和生物学试验方法)、GB/T 15812.1-2005 非血管内导管第1部分:一般性能试验方法、YY/T 1536-2017 非血管内导管表面滑动性能评价用标准试验模型等。
如产品带涂层,或宣称“超滑”,应有性能的确定依据及所采用的标准或方法、采用的原因及理论基础。
关注点:
1.外观:管身、尖部、球囊和孔眼应无外来物质,且不应有加工缺陷和表面缺陷。
2.尺寸:导尿管应用其公称外径(mm)表示其规格,精确到0.1mm。其公差应为±0.33mm。球囊容积应以毫升(ml)表示。
3.强度:当按YY 0325-2016附录A所给方法试验时,尖部和锥形接口应与管身连为一体,管身应无断裂。
4.连接器分离力:当按YY 0325-2016附录B所给方法试验时,排泄锥形接口应不与试验连接器分离。
5.球囊可靠性:当按YY 0325-2016附录C所给方法试验时,球囊应无泄露,并且不应影响排泄孔;当按YY 0325-2016附录D所给方法试验时,水的回收率应不低于YY 0325-2016表D.2的规定值。
6.耐弯曲性:按YY 0325-2016附录E试验时,弯曲导尿管各腔的液体流量应不低于平直导尿管液体流量的50%。
7.流量:向球囊中充入公称容积的蒸馏水,按GB/T 15812.1-2005中附录E所给方法试验时,流量应符合YY 0325-2016表2规定。仅需列出申报规格的流量要求。
8.无菌:明确灭菌方式。
9.耐腐蚀性:适用于产品中的金属组件。
10.化学性能:根据不同材料的特性,应对产品材料的化学性能提出相应要求,如酸碱度、重金属、还原物质、蒸发残渣等。环氧乙烷灭菌的产品应规定环氧乙烷残留量不得大于10μg/g。
11.表面滑动性能:适用于带涂层或宣称超滑的产品。
(二)生物相容性评价研究
生物相容性评价研究资料应当包括:
1.生物相容性评价的依据和方法。
本评价是对导尿管进行的医疗器械生物学评价,依据GB/T 16886.1-2011 医疗器械生物学评价第1部分:风险管理过程中的评价与试验中图1作为风险管理组成部分的医疗器械生物学评价的系统方法框图开展。
2.产品所用材料的描述及与人体接触的性质。
应关注导尿管管身、球囊(如有)、金属部件(如有)、涂层(如有)的材质或成分。
本产品按人体接触性质分类为表面器械b黏膜(与无损伤黏膜接触的器械);按接触时间分类为B长期接触(24h以上30d以内)。
3.对于现有数据或试验结果的评价。
不同材质、带涂层的产品应分别进行生物学试验。
根据具有资质的检验机构出具的检验报告,细胞毒性、皮肤致敏、刺激等生物学试验结果均符合要求,表明导尿管所用材料具有安全的生物学特性,可进行临床使用。
(三)灭菌/消毒工艺研究
查看灭菌/消毒确认报告,重点关注灭菌工艺(方法和参数)、无菌保证水平(SAL)。
(四)产品有效期和包装研究
查看有效期和包装验证报告,重点关注以下内容:
1.有效期:期限、加速老化或实时老化的试验方法及结论。
2.包装及包装完整性:根据产品的包装材质是否有合适的包装完整性试验,如无菌实验、真空泄漏实验、染料渗漏试验、琼脂接触攻击试验、密封强度测试等,并进行外包装抗压、跌落、模拟运输等测试,并有试验结论。
七、生产制造信息
应关注工艺流程图,应标明关键工序、特殊工艺、委外工序等。
八、临床评价资料
应关注是否依据《医疗器械临床评价技术指导原则》提交了临床评价资料。
九、产品风险分析资料
参照YY/T 0316进行风险分析,应不存在不可接受级别的风险项,所有的剩余风险都是可以接受的。
十、产品技术要求
医疗器械产品技术要求应当按照《医疗器械产品技术要求编写指导原则》的规定编制。
应根据产品自身特点,参考相应的国家、行业标准制定产品技术要求,如有不适用条款(包括国家标准、行业标准要求),应在申报资料中说明理由。产品技术要求中应明确规格型号的划分、产品的结构组成、产品材质等内容。
导尿管技术要求举例详见附件。
十一、产品注册检验报告
(一)按国家/省药监部门最新规定查看检验报告。
(二)同一注册单元如有单腔、双腔、三腔等多种形式,以三腔导尿管为典型产品送检;如有不带涂层、带涂层多种形式,以带涂层产品为典型产品送检。
(三)同一注册单元中如有不同材质的产品,应分别进行检验。
十二、产品说明书和最小销售单元的标签样稿
导尿管的说明书、标签应符合相关法规规定、《医疗器械说明书和标签管理规定》。
(一)医疗器械说明书一般应当包括以下内容:
1.产品名称、型号、规格;
2.注册人的名称、住所、联系方式及售后服务单位;
3.生产企业的名称、住所、生产地址、联系方式及生产许可证编号;
4.医疗器械注册证/产品技术要求编号;
5.产品性能、主要结构组成、材质、适用范围、适用人群;
6.产品使用说明(方法);不同结构的导尿管如使用方法不同,建议分别描述;
7.产品储存、运输条件、方法;
8.禁忌症、注意事项、警示以及提示的内容,至少包括但不限于以下内容:
(1)对产品允许留置人体的时间进行说明,本产品留置时间应小于30天;
(2)对应用长时间留置产品的患者如何监护进行说明;
(3)应提示对产品材料过敏者、尿道炎症严重者禁用;
(4)应提示一次性使用,用后销毁,包装如有破损,严禁使用;
(5)应提示灭菌方式;
(6)产品有效期若是通过加速老化试验获得,应标明;
(7)明确标示可使用的润滑剂名称。对于乳胶导尿管类产品,警示不可使用的石油基质润滑液,如凡士林、液体石蜡等;对于硅胶材质的导尿管,警示避免使用硅酮类润滑剂,如硅油等。
(8)提示球囊充盈体积;
(9)给出临床使用中如出现阻塞、渗漏、球囊破裂、拔出困难等情况的推荐处理方式。
9.生产日期,使用期限或者失效日期;
10.说明书的编制或者修订日期;
11.标签所用的图形、符号、缩写等内容的解释;
12.其他应标注的内容。
(二)医疗器械标签一般应当包括以下内容:
1.产品名称、型号、规格、公称球囊容积;
2.注册人的名称、住所、联系方式;
3.医疗器械注册证/产品技术要求的编号;
4.生产企业的名称、住所、生产地址、联系方式及生产许可证编号;
5.生产日期,使用期限或者失效日期;
6.根据产品特性应当标注的图形、符号以及其他相关内容;
7.导尿管材质;
8.明确标示可使用的润滑剂名称。对于乳胶导尿管类产品,警示不可使用的石油基质润滑液,如凡士林、液体石蜡等;对于硅胶材质的导尿管,警示避免使用硅酮类润滑剂,如硅油等;
9.标明“其它内容详见说明书”。
十三、符合性声明
(一)符合性声明:声明本产品符合《医疗器械注册管理办法》和相关法规的要求;声明本产品符合《医疗器械分类规则》有关分类的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
(二)申请材料的真实性保证声明。
(三)申请企业承诺。
注:以上表格可至“江苏政务服务”官网下载。
附件:一次性使用无菌导尿管技术要求举例
附件
医疗器械产品技术要求
医疗器械产品技术要求编号:XXXXXXXXX
一次性使用无菌导尿管
1.产品型号/规格及其划分说明
1.1组成结构
一次性使用无菌导尿管(以下简称:导尿管)分为单腔、两腔和三腔。结构见图1-图3。
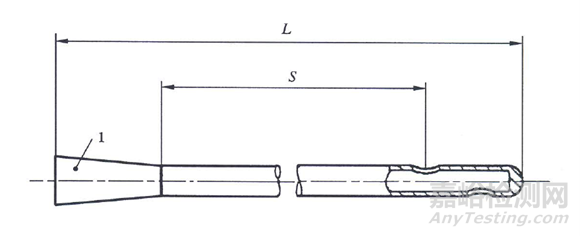
L-导尿管全长;S-管身有效长度
图1 单腔导尿管外形结构示意图
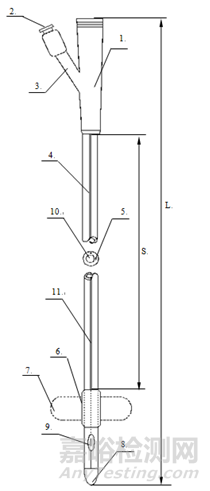
1-排泄锥形接口;2-止逆阀;3-充起锥形接口;4-管身;5-充起腔;6-球囊;7-球囊(充起状态);8-头端;9-孔眼(侧孔);10-排泄腔;11-造影线
L-导尿管全长;S-管身有效长度
图2 两腔导尿管外形结构示意图
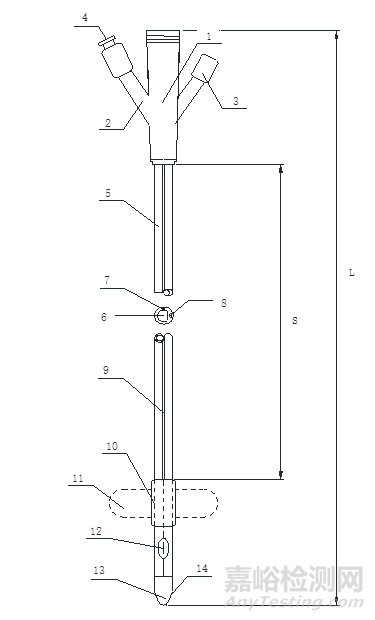
1-排泄锥形接口;2-充起锥形接口;3-冲洗锥形接口;4-止逆阀;5-管身;6-排泄腔;7-充起腔;8-冲洗腔;9-造影线;10-球囊;11-球囊(充起状态);12-孔眼(侧孔);13-头端;14-冲洗孔
L-导尿管全长;S-管身有效长度
图3三腔导尿管外形结构示意图
1.2型号规格
导尿管的型号规格见表1。
表1导尿管型号规格表
|
型号 |
规格 |
公称外径(Φ)/mm ±0.33 |
导尿管 标称全长(L)/mm ±50 |
有效长度(S)/mm |
球囊容积 /ml |
|
|
|
|
|
|
|
 1.3材料
1.3材料
导尿管的部件所用的材料见表2。
表2导尿管构成部件材料表
|
构成部件 |
材质 |
符合的标准 |
|
管身 |
|
|
|
涂层(如有) |
|
|
|
球囊 |
|
|
|
…… |
|
|
2.性能指标
2.1外观
管身、尖部、球囊和孔眼应无外来物质,且不应有加工缺陷和表面缺陷。
2.2尺寸
导尿管应用其公称外径(mm)表示其规格,精确到0.1mm。其公差应为±0.33mm。球囊容积应以毫升(ml)表示。
球囊导尿管的管身外径、全长、有效长度、球囊容积应符合表1的规定。
2.3强度
当按YY 0325-2016附录A所给方法试验时,尖部和锥形接口应与管身连为一体,管身应无断裂。
2.4连接器分离力
当按YY 0325-2016附录B所给方法试验时,排泄锥形接口应不与试验连接器分离。
2.5球囊可靠性
2.5.1当按YY 0325-2016附录C所给方法试验时,球囊应无泄露,并且不应影响排泄孔。
2.5.2当按YY 0325-2016附录D所给方法试验时,水的回收率应不低于表3的规定值。
表3球囊试验回收百分率
|
公称球囊容积 ml |
试验体积回收最小百分比 % |
|
3 5 10 15 20 30及以上 |
50 55 75 75 80 80 |
2.6耐弯曲性
按YY 0325-2016附录E试验时,弯曲导尿管各腔的液体流量应不低于平直导尿管液体流量的50%。
2.7流量
向球囊中充入公称容积的蒸馏水,按GB/T 15812.1-2005中附录E所给方法试验时,流量应符合表4规定。
表4平均流量
|
标称规格 |
平均流量(最小值) |
||
|
外径(mm) |
规格(Fr) |
排泄腔(mL/min) |
冲洗腔(mL/min) |
|
2.0 |
6Fr |
10 |
不适用 |
|
2.7 |
8Fr |
15 |
不适用 |
|
3.3 |
10Fr |
30 |
不适用 |
|
4.0 |
12Fr |
50 |
不适用 |
|
4.7 |
14Fr |
70 |
25 |
|
5.3 |
16Fr |
100 |
25 |
|
6.0 |
18Fr |
100 |
25 |
|
6.7 |
20Fr |
100 |
25 |
|
7.3 |
22Fr |
100 |
30 |
|
8.0 |
24Fr |
100 |
30 |
|
8.7 |
26Fr |
100 |
30 |
|
9.3 |
28Fr |
100 |
不适用 |
|
10.0 |
30Fr |
100 |
不适用 |
2.8无菌
产品应无菌。
2.9耐腐蚀性(如适用)
如有金属部件,按GB/T 15812.1-2005中附录A进行试验时,试样应无腐蚀迹象。
2.10 化学性能
2.10.1环氧乙烷残留量(如适用)
环氧乙烷残留量应不大于10μg/g。
2.10.2酸碱度
检验液与同批空白对照液相比,pH值之差不得超过2.0。
2.10.3重金属含量
检验液重金属总含量不超过5μg/ml。
2.10.4还原物质
检验液与空白液消耗浓度为0.002mol/L高猛酸钾溶液的体积之差应不超过2.0ml。
2.10.5蒸发残渣
蒸发残渣总量不超过2.0mg。
2.11涂层表面滑动性能(如适用)
按YY/T 1536-2017所给方法试验,滑动性能的试验力值应符合制造商的规定。
3.检验方法
3.1外观
手感,目测,结果应符合2.1的要求。
3.2尺寸
用通用或专用量具测量,结果应符合2.2的要求。
3.3强度
按YY 0325-2016附录A所给方法进行试验,结果应符合2.3的要求。
3.4连接器分离力
按YY 0325-2016附录B所给方法进行试验,结果应符合2.4的要求。
3.5球囊可靠性
3.5.1按YY 0325-2016附录C所给方法进行试验,结果应符合2.5.1的要求。
3.5.2按YY 0325-2016附录D所给方法进行试验,结果应符合2.5.2的要求。
3.6耐弯曲性
按YY 0325-2016附录E的方法进行试验,结果应符合2.6的要求。
3.7流量
按GB/T 15812.1-2005中附录E所给方法进行试验,结果应符合2.7的要求。
3.8无菌
按中华人民共和国药典(2020年版四部)的方法进行检验,结果应符合2.8的规定。
3.9耐腐蚀性试验(如适用)
按GB/T 15812.1-2005中附录A的方法进行试验,结果应符合2.9的要求。
3.10化学性能
3.10.1环氧乙烷残留量(如适用)
按GB/T 14233.1-2008中规定的方法进行测试,结果应符合2.10.1的要求。
3.10.2酸碱度试验
取检验液,按GB/T 14233.1-2008中5.4.1规定的方法进行,结果应符合2.10.2的要求。
3.10.3重金属总含量试验
取检验液,按GB/T 14233.1-2008中5.6.1规定的方法进行,结果应符合2.10.3的要求。
3.10.4还原性物质试验
取检验液,按GB/T 14233.1-2008中5.2.2规定的方法进行,结果应符合2.10.4的要求。
3.10.5蒸发残渣试验
取检验液,按GB/T 14233.1-2008中5.5规定的方法进行,结果应符合2.10.5的要求。
3.11 涂层表面滑动性能(如适用)
按YY/T 1536-2017所给方法试验,应符合2.11的要求。

来源:江苏省药品监督管理局审


