今日头条
先声脑梗死复方舌下片III期临床积极。先声药业与宁丹新药合作开发的先必新舌下片治疗急性缺血性脑卒中(AIS)的III期临床达到疗效终点。与安慰剂相比,先必新舌下片显著改善AIS患者治疗后神经功能恢复及独立生活能力,且耐受性良好。先必新舌下片(Y-2舌下片)是一种含有依达拉奉和右莰醇两种活性成分的口服固体制剂。此前,先必新(依达拉奉右莰醇注射用浓溶液)已获NMPA批准上市,用于改善急性脑梗塞所致的神经症状。
国内药讯
1.翰森新一代EGFR-TKI在欧洲报产。翰森制药与EQRx公司合作开发的第三代EGFR-TKI甲磺酸阿美替尼片的上市申请获欧洲药品管理局受理,用于一线治疗具有EGFR敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,及治疗存在EGFR T790M突变阳性的局部晚期或转移性NSCLC成人患者。在Ⅲ期AENEAS研究中,与吉非替尼相比,阿美替尼可显著延长患者无进展生存期(中位PFS:19.3个月vs9.9个月)。
2.齐鲁PD-1/CTLA-4双抗Ⅱ期临床积极。齐鲁制药在ESMO2022亚洲大会上公布PD-1/CTLA-4双抗QL1706联合化疗+/-贝伐珠单抗治疗晚期非小细胞肺癌(NSCLC)的Ⅱ期临床积极结果。在EGFR野生型患者中,中位随访为9.17个月时,患者的客观缓解率(ORR)为58.6%,其中鳞状NSCLC患者ORR为70.6%,非鳞状NSCLC患者ORR为41.7%;患者的疾病控制率(DCR)为93.1%(27/29)。在EGFR突变型的晚期NSCLC患者中,中位随访为5.75个月时,ORR为64.5%(20/31),DCR为93.5%(29/31)。
3.翰宇鼻喷型新冠药启动II期临床。翰宇药业1类创新药HY300鼻喷雾II期临床研究方案获得组长单位南方医科大学珠江医院学伦理委员会伦理审查批件,用于严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)感染的暴露前预防。HY3000是一种膜融合抑制剂多肽,作用于新冠病毒刺突蛋白的HR1区域,通过HR1区域结合,阻止病毒六螺旋束结构形成,阻断病毒侵染细胞的路径。
4.迈威CD47/PD-L1双抗临床前研究见刊。迈威生物CD47/PD-L1双抗6MW3211的临床前研究结果在线发表在国际期刊Theranostics上。6MW3211在转基因小鼠模型上显示出显著抑制肿瘤生长,延长小鼠生存期。在PD-L表达肿瘤细胞中,6MW3211中CD47抗体臂的抗肿瘤效果显著提高。在恒河猴的毒理试验中,6MW3211在200mg/kg剂量下未观察到任何红细胞毒性。6MW3211目前正在多项Ⅱ期临床中评估用于治疗透明细胞肾细胞癌、淋巴瘤和肺癌的潜力。
5.勤浩抗耐药ERK1/2抑制剂获批临床。勤浩医药双机制ERK1/2抑制剂新药GH55获FDA临床许可。GH55在抑制ERK1/2激酶活性的同时,能够抑制MEK对于ERK1/2的激活,防止由于负反馈调节造成的耐药。今年9月,GH55胶囊的国内IND申请已获得NMPA批准,拟开发用于MAPK信号通路突变的晚期实体瘤。目前全球范围内尚无ERK1/2抑制剂获批上市。
国际药讯
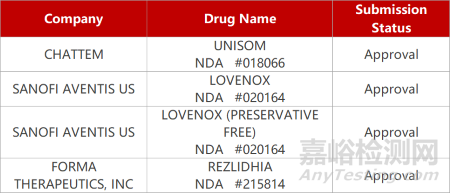
1.创新IDH1抑制剂治疗AML获批上市。Rigel公司与Forma公司开发的IDH1选择性抑制剂Rezlidhia(olutasidenib)获FDA批准上市,用于治疗IDH1突变、复发或难治性急性髓系白血病(AML)患者。Olutasidenib可通过抑制突变IDH1降低2-羟基戊二酸(2-HG)水平和恢复正常髓系细胞的分化。在Ⅱ期临床中,Rezlidhia在这类患者中达到35%缓解率,中位缓解持续时间为25.9个月。
2.GSK开发PD-1抗体子宫内膜癌Ⅲ期临床成功。葛兰素史克(GSK)PD-1抗体Jemperli(dostarlimab)一线治疗原位晚期或复发性子宫内膜癌的Ⅲ期RUBY试验达到主要终点。无论是在总患者群体或是dMMR/MSI-H亚群中,使用Jemperli与标准化疗的组合疗法再以Jemperli治疗的患者,研究人员评估的PFS均显著优于安慰剂组。在MMRp/MSS群体中,亦可见到在PFS上的临床益处。预计该公司将在2023年上半年递交补充监管申请。
3.罗氏皮下注射PD-L1抗体Ⅲ期临床成功。罗氏PD-L1抗体Tecentriq(atezolizumab)皮下制剂治疗局部晚期或转移性非小细胞肺癌(NSCLC)的Ⅰb/Ⅲ期试验(IMscin001)获积极结果。该试验此前已达到主要终点,与需要30-60分钟的静脉(IV)输注相比,只需3-8分钟的皮下注射Tecentriq在血液中的水平(药代动力学)显示出非劣效性。最新数据显示,接受Tecentriq皮下制剂与静脉输注患者的总缓解率和无进展生存期相当。两者在安全性方面也展现一致性。
4.赛诺菲昏睡病口服新药Ⅱ/Ⅲ期临床积极。非营利性药物研发组织“被忽视疾病药物倡议”(DNDi)与赛诺菲开发的单次口服给药的新化学药物acoziborole,在刚果和几内亚针对昏睡病开展的Ⅱ/Ⅲ期临床结果积极。208例确诊患者服用一剂acoziborole后达到95%有效率,详细结果已发表在《柳叶刀-传染病上》。昏睡病是一种通过采采蝇叮咬传播的寄生虫病,也被称为非洲人类锥虫病(HAT)。
5.Sigma-1受体激活剂治疗AD IIb/III期临床成功。Anavex Life Sciences公司开发的口服小分子sigma-1(σ-1)受体激活剂ANAVEX®2-73 (blarcamesine),在治疗阿尔茨海默病(AD)引起的轻度认知障碍(MCI)的IIb/III研究ANAVEX®2-73-AD-004达到主要终点及关键次要终点。与安慰剂相比,ANAVEX®2-73治疗组患者AD评定量表(ADAS-Cog)评分平均下降4.03分,下降≥0.50分(p=0.015)的患者比例超过84%;该组日常生活活动量表(ADCS-ADL)评分增加≥3.5分 (p=0.0255),改善功能的可能性提高167%。药物的总体耐受性良好。
6.阿斯利康FIC淀粉样蛋白单抗II期研究积极。阿斯利康旗下Alexion公司将在ASH2022年会上公布潜在first-in-class淀粉样蛋白单抗CAEL-101针对轻链淀粉样变性(AL)患者的II期研究(NCT04304144)积极结果。最新数据显示,22例心脏可评估患者接受CAEL-101治疗1年后,有46%的患者达到临床缓解,18%的患者病情稳定。在9例肾脏可评估患者中,有89%患者的蛋白尿较基线减少≥30%。所有25例患者均经历不良反应,多为轻中度。60%患者经历3级及以上的不良反应。
7.溶瘤病毒联合疗法获FDA快速通道认定。FDA授予Oncolytics Biotech公司溶瘤病毒Pelareorep与罗氏PD-L1阿替利珠单抗、吉西他滨和白蛋白紫杉醇的联合方案快速通道资格,用于一线治疗晚期/转移性胰腺导管腺癌(PDAC)。在I/II期GOBLET研究中,Pelareorep组合疗法达到69%的客观缓解率,包括1例完全缓解和8例部分缓解,是历史对照试验(吉西他滨联合白蛋白紫杉醇)中平均ORR的3倍。
医药热点
1.上海:公交和室外公共场所不再查验核酸证明。12月4日,上海市疫情防控工作领导小组办公室发布优化调整疫情防控的相关措施,具体为:乘坐轨道交通、地面公交、轮渡等市内公共交通工具,不再查验核酸检测阴性证明;全市公园、景区等室外公共场所,不再查验核酸检测阴性证明。以上优化调整措施自12月5日零时起实施。
2.北京新冠肺炎线上咨询平台再次上线运行。根据北京地区新冠肺炎疫情形势,北京医学会再次启动北京市新冠肺炎线上医生咨询平台,方便市民足不出户即可获得疫情防治相关知识和医学方面的专业指导。北京医学会此次安排了呼吸病学、感染病学、老年医学、儿科学、围产医学、心理学、急诊医学、全科医学等8个专科分会的专家参与平台工作,每日从8时至22时,由专家在线回答群众提出的咨询问题。
3.广州:新冠症状同感冒,毒力不如流感严重。12月2日晚8点,多位医学专家联合发布重磅判断,广州这波新冠疫情当中,奥密克戎变异株引起的症状大部分都很轻,症状同季节性感冒类似;超过90%都是无症状感染者,无需太多的治疗干预;轻症患者的治疗按照普通感冒的治疗手段处理,平均住院时间一般10天左右。专家呼吁市民无需恐慌。
4.冠脉支架接续集采拟中结果出炉。11月29日,国家组织冠脉支架集采协议期满后接续采购在江苏常州开标,产生拟中选结果。与上一轮集采相比,本次接续采购参加的医疗机构增加40%,支架采购量增加30%。共有10家企业的14个产品获得拟中选资格,平均中选支架价格770元左右,加上伴随服务费,终端价格区间在730元至848元,预计2023年1月患者将用上接续采购的中选产品。
评审动态
1. CDE新药受理情况(11月23日)

2. FDA新药获批情况(北美12月01日)