12月28日,FDA批准了TG医疗公司的Ublituximab(Briumvi),用于复发型的多发性硬化症(MS)治疗,临床孤立综合征、复发缓解型疾病和活动性继发性进展性疾病。这是本年度CDER批准的第36个药物。
Ublituximab是一种CD20抗体,是一种利妥昔单抗的biobetter,FDA批准本品上市是基于两项针对复发性MS患者设计的随机双盲试验的研究结果。入组试验1的患者分别接受本品(n=274)或特立氟胺(n=275)治疗,两组分别有88%和92%的患者完成了为期96周的临床研究。入组试验试验2的患者也分别接受本品(n=272)或特立氟胺(n=273)治疗,两组分别有93%和88%的患者完成了为期96周的临床研究。
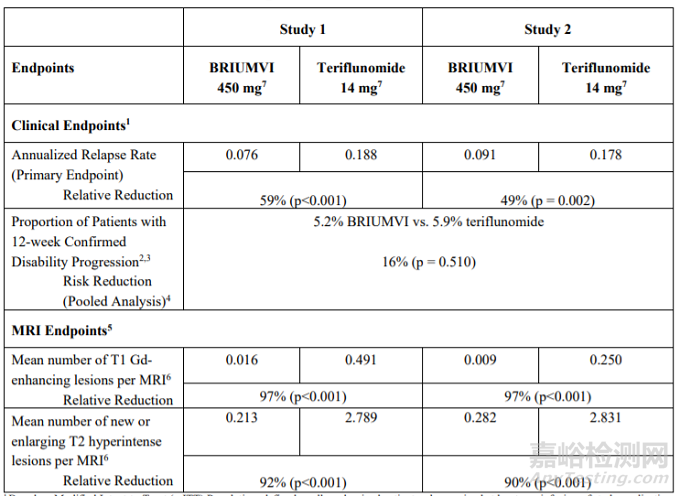
两项试验的入组患者均在入组前的1年中至少复发1次、前2年中至少复发2次、或在前1年中新出现钆(Gd)增强下的可见病灶,扩展的残疾状态量表(EDSS)均处于0-5.5分。两项试验的主要终点均为年后复发率(ARR)、次要终点为96周时钆增强核磁显影下的病灶数量、新增或扩大的高强度核磁显影的T2病灶数,以及至少12周内疾病进展的患者比例。
随访结果显示,本品治疗组在两项试验中的ARR分别为0.076和0.091,而对应的特立氟胺治疗组分别为0.188和0.176,本品治疗组在两项试验中的96周平均钆增强核磁显影下的病灶数量分别为0.016和0.009,而对应的特立氟胺治疗组分别为0.491和0.250,本品治疗组在两项试验中的96周平均新增或扩大的高强度T2病灶数量分别为0.231和0.282,而对应的特立氟胺治疗组分别为2.789和2.831,综合两项试验的数据,本品和特立氟胺治疗组的12周内疾病进展的患者比例分别为5.2% vs 5.9%。