摘 要 / Abstract
目的:分析总结医疗器械注册技术审评沟通交流问题,探讨医疗器械注册技术审评机构开展的沟通交流工作方式。方法:收集2020年4月~2022年4月安徽省药品审评查验中心网站技术咨询栏目登记的与医疗器械注册技术审评相关的咨询问题,按照问题类别进行分类统计分析,归纳沟通交流存在的常见问题,并提出改进建议。结果:共收集191例咨询问题,其中政策咨询类问题52例、技术咨询类问题139例。政策咨询类问题主要涉及医疗器械法规解读等形式性审查环节的要求,技术咨询类问题主要涉及注册申报要求和技术审评标准等实质性审查环节的要求。沟通交流中的常见问题包括提交的证据资料不充分、沟通交流目的不明确和沟通交流需求不具体等。结论:通过完善沟通交流制度,明确需求,健全机制,夯实能力,提升沟通交流针对性,可以确保医疗器械注册技术审评沟通交流科学严谨,取得实效,推动医疗器械产业健康和高质量发展。
Objective: To analyze and summarize the communication problems of medical device registration technical evaluation, and to explore the communication methods of provincial medical device registration technical evaluation institutions. Methods: The consultation questions related to medical device registration technical evaluation registered in the technical consultation column of the website of Anhui Center for Drug Evaluation and Inspection from April 2020to April 2022 were collected, classified and statistically analyzed according to the category of these questions. Then this paper summarized the common problems in communication, and put forward suggestions for improving communication.Results: A total of 191 cases of consultation questions were collected, including 52 cases of policy consultation and 139cases of technical consultation. Policy consultation mainly involves formal review requirements such as interpretation of medical device regulations, and technical consultation mainly involves substantive review requirements such as registration and application requirements and technical evaluation standards. Common problems in communication include insufficient evidence submitted, unclear communication purpose, and unspecific communication needs. Conclusion: By improving the communication system, clarifying the needs, improving the mechanism, consolidating the ability, and improving the pertinence of communication, we can ensure that the communication of medical device registration technology evaluation is scientific and rigorous, achieving practical results, and promoting healthy and high-quality development of the medical device industry.
关 键 词 / Key words:医疗器械;技术审评;沟通交流;建议
medical device; technical evaluation; communication; suggestions
技术审评是医疗器械上市前注册管理的重要技术支撑,主要依照法定程序,对拟上市医疗器械的安全、有效和质量可控进行评价,提出是否准予注册的建议[1]。由于医疗器械涉及技术领域广、专业性强,且技术审评工作涉及大量法律法规、标准和指导原则等要求,因此对医疗器械技术审评人员和注册申请人提出了较高的能力要求。2017年10月中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[2],提出建立完善注册申请人与审评机构的沟通交流机制。《医疗器械注册与备案管理办法》[3]第二十二条和《体外诊断试剂注册与备案管理办法》[4]第二十三条均规定:医疗器械专业技术机构建立健全沟通交流制度,明确沟通交流的形式和内容,根据工作需要组织与申请人进行沟通交流。安徽省药品审评查验中心作为负责安徽省医疗器械注册审评工作的专业技术机构,根据审评审批制度改革精神,于2020年发布沟通交流(咨询接待)管理规定,明确每周设立专门的现场咨询接待日,不断加强技术审评人员与注册申请人的沟通交流。经过3年实践,常态化的沟通交流工作有效解决了申请人在医疗器械设计研发和上市注册过程中的诸多困惑,为助推安徽省医疗器械产业高质量发展起到了一定的作用。
本文收集了2020年4月~2022年4月安徽省药品审评查验中心网站技术咨询栏目登记的与医疗器械注册技术审评相关的咨询问题,按照问题类别进行分类统计分析,归纳沟通交流存在的常见问题,并提出改进建议,以期为探索医疗器械技术审评机构开展沟通交流工作方式提供参考。
1、问题分析
1.1 收集的咨询问题
2020年4月~2022年4月,共收集191例与医疗器械注册技术审评相关的咨询问题,其中在线咨询31例、现场咨询160例。在线咨询形式主要有会议咨询、视频咨询和邮件咨询等。沟通交流对象包括注册人/备案人、已获证的生产企业、科研机构、临床机构和技术咨询服务机构等。按照问题类别,咨询问题可分为政策咨询类问题(52例)和技术咨询类问题(139例)。其中,政策咨询类问题涉及首次注册39例、变更注册10例、延续注册3例;技术咨询类问题涉及首次注册98例、变更注册36例、延续注册5例。
1.1.1 政策咨询类问题
政策咨询类问题主要涉及法律法规解读、产品注册流程、创新产品申报、优先审批等医疗器械注册管理制度合法性方面的问题。例如,注册申报流程和注册总时限;技术审评程序和时限;提交医疗器械产品自检报告与提交委托有资质的医疗器械检验机构出具的检验报告的异同;医疗器械检验机构资质的判定;医疗器械产品分类的界定;产品类别调整后如何办理注册,分类界定文件内容与注册申报资料的关系;产品发生何种变化时需要申请变更注册;注册人制度下医疗器械产品注册与质量管理体系核查的关注点;优先审批产品的申请条件以及如何申报创新产品等。
1.1.2 技术咨询类问题
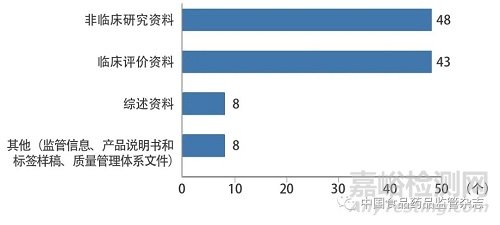
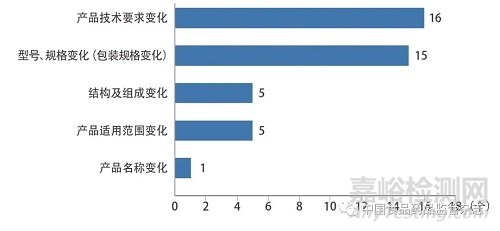
技术咨询类问题主要涉及医疗器械(体外诊断试剂)注册申报资料撰写要求,注册技术审查指导原则和国家标准、行业标准的适用性等技术审评合规性方面的问题。本文结合《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》[5]和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》[6]中注册申报资料内容框架,对咨询较多的注册形式问题(首次注册和变更注册)进行了分析,其中98例首次注册的技术咨询共涉及107个咨询问题,36例变更注册的技术咨询共涉及42个咨询问题,如图1、图2所示。
图1 首次注册的技术咨询类问题分布情况
图2 变更注册的技术咨询类问题分布情况
首次注册的技术咨询类问题主要集中在非临床研究资料和临床评价资料。非临床研究资料问题包括产品技术要求及检验报告问题30个,生物学研究问题7个,稳定性研究问题5个,其他问题6个。其中,产品技术要求及检验报告问题主要包括产品性能指标确定的依据、产品对国家标准和行业标准的适用性、注册技术审查指导原则对产品性能指标的要求、同一注册单元典型产品的检验报告能否覆盖所有申报产品、创新产品如何制定产品技术要求、企业自定性能指标检测方法如何确定、自检报告的格式要求、产品型号规格的划分原则和注意事项、参照已上市同品种医疗器械产品性能指标编制的产品技术要求是否科学等。生物学研究问题和稳定性研究问题主要集中在研究依据和研究方法的确定。临床评价资料问题包括符合免于临床评价的医疗器械(体外诊断试剂)的判定标准、临床评价资料撰写格式和内容、临床试验方案的设计原则、临床试验样本量的确定、临床试验对照(比)产品或诊断金标准的选择、临床试验研究评价终点的选择以及如何通过已上市同品种医疗器械比对开展临床评价、等同性论证的标准、临床评价文献的选取标准等。综述资料问题和其他相关申报资料问题集中在资料撰写的规范性要求。
变更注册的技术咨询类问题主要集中在产品技术要求变化和型号、规格变化(包装规格变化)。其中产品技术要求变化问题(16个)主要包括变更注册过程中是否能够提供自检报告;产品因增加型号、规格引起产品技术要求变化和如何选取典型产品注册送检;产品贯彻新实施的国家标准和行业标准引起产品技术要求变化;产品性能升级引起产品技术要求变化等。型号、规格变化(包装规格变化)问题(15个)主要集中在不引起产品技术要求变化是否需要进行检验。其他问题(11个)包括产品结构及组成未发生实质性变化,如原材料供应商发生变化是否需要申请变更注册;产品适用范围未发生实质性变化是否需要开展临床评价;变更产品适用范围是否可以通过已上市同品种医疗器械比对途径开展临床评价等。
1.2 沟通交流存在的常见问题
经统计,沟通交流中的常见问题主要表现在以下两方面:(1)提交的证据资料不充分。例如,咨询临床试验样本量的确定方法时,缺少样本量估算参数的设定依据;咨询产品性能指标确定的科学性时,未提供充足的性能研究依据;咨询医用电气设备有效期确定方法时,未提供产品的具体特征信息等。(2)沟通交流目的不明确,沟通交流需求不具体。例如,主题为咨询临床评价路径选择的问题,而实际则是咨询何种情形下产品能够满足免于临床评价的要求;笼统咨询尚未发布注册技术审查指导原则的产品如何确定性能指标、临床试验方案是否完善等。
2、问题探讨
2.1 收集的咨询问题
2.1.1 政策咨询类问题
近年来,科技发展日新月异,医疗器械产业加速升级,产品上市进度快慢直接影响企业生存和产业前景,因此申请人十分关注上市注册申报各环节流程和时限[7]。2021年新修订的医疗器械注册相关法规陆续实施,注册申报资料允许提交自检报告和制定完善的临床评价指导原则体系是本次相关法规修订中涉及上市前注册要求的重大变化。例如,《医疗器械注册与备案管理办法》第三十二条和《体外诊断试剂注册与备案管理办法》第三十三条规定:申请注册或者进行备案提交的医疗器械产品检验报告可以是申请人、备案人的自检报告;《医疗器械注册与备案管理办法》第三十五条和第三十六条规定进一步明确了开展医疗器械临床评价的原则、要求和路径。因此,申请人特别希望了解上述变化带来的政策红利。此外,产品的类别界定及调整、变更注册的法规内涵、注册人制度及优先审批的政策解读也是申请人关注的问题。主要是由于近年来以移动医疗、数字医疗和健康体检类产品为代表的有源医用电气设备和以临床使用为导向的无源手术器械产品申报数量逐年增多。经统计,有源医疗器械和无源医疗器械的咨询问题为151例,申请人对涉及这两类产品的政策背景和审评审批制度举措的沟通交流意愿十分迫切。安徽省药品审评查验中心作为技术审评机构,主要专注于法规政策执行层面的技术审评环节,对于很多法规政策问题的解读可能还需要通过咨询上级注册管理部门,再将注册管理部门对于法规条款、政策文件的解释、意见和建议告知申请人。如遇到疑难复杂或不属于技术审评范畴问题,审评人员会第一时间告知申请人如何与注册管理部门直接取得沟通联系,以确保政策咨询问题解答及时准确。
2.1.2 技术咨询类问题
自2014年版《医疗器械监督管理条例》修订以来,配套规章、技术性文件陆续出台,医疗器械法规体系日臻完善。但由于对医疗器械法规和注册申报要求的关注不及时或理解不充分,部分申请人在咨询过程中常会提出已经在法规中有明确规定或解释的问题。例如,申请人经常咨询注册自检报告格式要求和临床评价资料的撰写要求,而国家已出台配套的自检管理规定和完备的临床评价指导原则文件。此外,部分申请人存在对医疗健康产业的特殊性和风险性的认识不足。例如,片面认为产品外观变化不属于变更注册范畴,未充分基于风险评估产品外观变化对医疗器械安全性和有效性可能产生的风险。2021年6月1日新修订《医疗器械监督管理条例》正式实施,标志着医疗器械监管步入新阶段。经过多年的法规实践和探索,新法规体系下医疗器械上市前注册管理要求日趋细化,技术审评体系不断完善。考虑到密集出台的新规定和审评理念的新变化,例如安全有效基本原则的评价标准、临床评价过程中的产品等同性论证尺度的确立、注册人制度的科学内涵及变更情形的决策依据等[8],部分申请人很难在短期内领会新法规的精髓要义和最新的审评理念,导致其在上市前注册过程中存在诸多困惑。作为技术审评机构,需要通过提前介入,靠前咨询,不断强化上市前的沟通交流力度,解答并纠正申请人对法规、标准和指导原则的认识盲区和理解偏差,同时技术审评沟通过程也能强化审评人员对法规实践的再认识。例如,《医疗器械注册自检管理规定》[9]明确了自检报告的形式和内容,从法规层面要求申请人提交合规的自检报告,从执行层面提醒审评人员要准确理解《医疗器械注册自检管理规定》对自检报告的要求,科学应对法规变化,准确梳理审评关注点,统一审评标准,确保《医疗器械注册自检管理规定》实施后技术审评工作有条不紊。保障相关法规的政策红利切实惠及申请人,也让沟通交流为医疗器械设计研发和质量控制提供技术服务。
2.2 沟通交流存在的常见问题
医疗器械技术审评沟通交流过程中常存在一些主观原因导致出现咨询无果或多次咨询的情况。这些主观原因主要包括:(1)申请人在填写咨询问题时未能提供充足的支持性资料;(2)咨询问题的关注点不清晰,沟通目的不明确;(3)咨询问题没有关注点,申请人与技术审评人员在有限的时间内缺乏沟通交流的基础。综上,如果审评人员与申请人在沟通交流过程中存在信息不对称,会造成沟通交流不能发挥应有的作用,存在一定的局限性,直接影响咨询效果。特别对于优先审批的新产品和创新产品,多次重复咨询可能会影响沟通交流质量和效率,还可能会耽误产品的研发进程。
3、改进建议
针对医疗器械注册技术审评沟通交流存在的局限性和对本文收集的各类咨询问题进行分析,笔者建议应基于沟通交流的针对性、实效性和科学性确保沟通交流质量和效率,切实满足人民群众对医疗器械产业高质量发展的需要。
3.1 明确沟通需求,提升沟通交流的针对性
基于当前在预约沟通交流或提交咨询问题时,申请人提供与问题相关的支持性证据材料准备不够充分、申请人对部分技术咨询类问题的表述过于简单笼统等情况,不利于审评人员及时了解申请人的沟通交流需求,特别是对于新研制产品、创新产品临床试验方案的统计学考量等新颖且复杂的问题,审评人员无法在短时间内进行充分思考或快速全面的解答,影响了沟通交流的有效性,降低了沟通交流的效率。为此,笔者建议技术审评机构进一步完善沟通交流(咨询接待)制度规定,细化咨询接待栏目的内容和形式,适时提供医疗器械注册技术审评咨询案例(参考样式),明确咨询问题内容的撰写要求,确保咨询问题主题明确、内容翔实、证据充分,以提升沟通交流的针对性。
3.2 健全沟通机制,推动沟通交流取得实效
沟通交流是技术审评机构提供咨询服务的重要手段,完善的沟通交流制度能够前置解决申请人在产品设计研发、体系核查、临床评价和注册申报过程中的诸多问题[10],提升产品上市进度。建议技术审评机构进一步健全沟通交流机制,注重建立与申请人之间的沟通桥梁,特别对首次注册和在研的创新产品,及时建立沟通咨询档案,强化咨询问题信息反馈并适时提供跟踪服务。针对政策问题和疑难技术问题,建议加强与上级注册管理部门、技术专家和临床专家的沟通,确保法规政策解读准确、技术解决方案符合法规要求。此外,针对申请人对法规认识不到位、风险意识不足等问题,技术审评机构可通过定期汇总咨询问题、共性问题并通过网站专栏公开,引导申请人举一反三,理解政策要领和审评要求。技术审评机构还应积极依托咨询接待平台加强政企交流力度,充分运用沟通交流手段强化对申请人的相关法律法规宣贯。建议以普及法规精神为目标、以解决关切问题为导向、以满足注册申请人需求为牵引,持续提升医疗器械注册技术审评咨询工作质量,把务实高效的沟通交流作为技术审评机构提前介入和靠前服务的抓手,为深化医疗器械审评审批制度改革提供新动力。
3.3 夯实沟通能力,确保沟通交流科学严谨
医疗器械具有学科交叉、技术更新快等特点,高新科技的迅猛发展对审评人员的专业能力提出新挑战。但限于科学认知、专业背景和知识结构的差异,审评人员对同一产品的理解不尽相同。随着人工智能、智慧医疗、3D打印、手术导航等新技术、新疗法大量涌现,客观上亟需提升技术审评队伍的能力水平,打造职业化、专业化、多学科融合的技术审评团队势在必行。技术审评机构应坚持以科学审评为目标,强化审评结论集体决策,统一审评尺度,保证技术审评和沟通交流的科学性、严谨性[11]。因此,建议技术审评机构持续优化审评人员结构,充实不同学科的专业人才,加强与审批部门、标准管理部门、检验检测部门、科研院所和临床试验机构等联系会商。通过开展技术审评机构内部法规研讨,强制性标准、指导原则解读和临床试验案例分享等多角度提升医疗器械技术审评人员的专业性,确保沟通交流科学严谨,从根本上减少申请人在设计开发和注册申报环节可能出现的政策困惑和技术难题,切实提高医疗器械技术审评质量和效率[12]。
4、结 语
本文对医疗器械技术审评机构沟通交流工作进行简要介绍,梳理了沟通交流过程中存在的常见问题和遇到的政策类和技术类咨询问题,并结合新修订医疗器械相关法规对咨询数量较多的问题进行了汇总分析。通过3年咨询接待工作实践,安徽省药品审评查验中心沟通交流制度逐步完善,特别是近年来国家鼓励医疗器械产业创新以及企业对医疗器械研发的投入与关注,及时、高效、科学的沟通交流能够提升医疗器械产品研发效率,加快医疗器械上市进度。在推进医疗器械审评审批制度改革的大背景下,崇尚法治精神,践行科学监管理念,遵循产业发展规律,建立符合医疗器械特点的技术审评评价体系任重道远。希望通过持续完善沟通交流制度,改进沟通交流方式方法,能够不断增进申请人与技术审评人员的沟通与互信,共同推动产业健康和高质量发展。