近日JANSSEN PHARMS宣布,旗下的盐酸艾司氯胺酮鼻喷雾剂(速开朗,SPRAVATO®,英文通用名:Esketamine Hydrochloride Nasal Spray)获得国家药品监督管理局(CDE)上市许可批准,用于与口服抗抑郁药联合,缓解伴有急性自杀意念或行为的成人抑郁症患者的抑郁症状。
吸入制剂
系指原料药物溶解或分散于适宜介质中,以气溶胶或蒸气形式递送至肺部发挥局部或全身作用的液体或固体制剂。吸入制剂需要借助吸入给药装置实现药物递送,大多属于药械组合产品,也属于复杂制剂,目前上市产品主要有吸入气雾剂、吸入粉雾剂、吸入喷雾剂及吸入用液体制剂4类。吸入制剂在制剂处方、给药装置、制剂工艺、质量研究、稳定性研究等方面均有其特殊关注点,可对吸入制剂的质量可控性、安全性与有效性产生至关重要的影响,因此质量控制研究部分是吸入制剂的临床前乃至临床研究重点之一。
法规要求
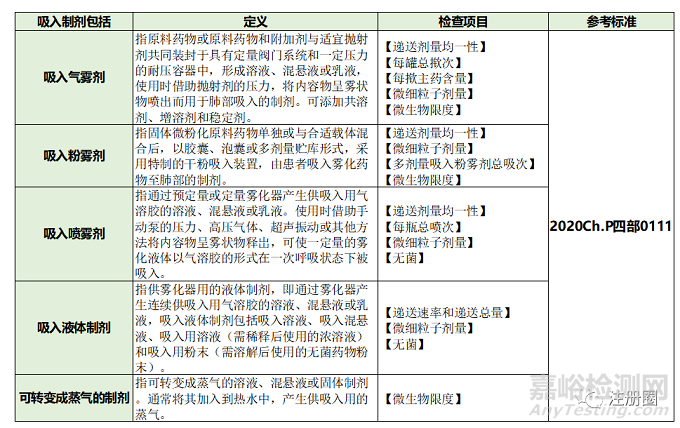
1. 在2020年版《中国药典》里将吸入制剂作为一个单独剂型收载,吸入制剂包括吸入气雾剂、吸入粉雾剂、吸入喷雾剂、吸入液体制剂和可转变成蒸气的制剂。2020年版《中国药典》四部0111还对吸入制剂的检测指标和检测方法进行了详细的叙述(见表1)。而盐酸艾司氯胺酮鼻喷雾剂属于吸入喷雾剂,除了需要进行表1的质量研究工作之外,还需要满足2020年版《中国药典》四部中0112 喷雾剂、0106 鼻用制剂的质量研究要求,见表2。
▲ 表1-2020年版《中国药典》四部0111 吸入制剂
▲ 表2-2020年版《中国药典》四部中0112 喷雾剂、0106 鼻用制剂
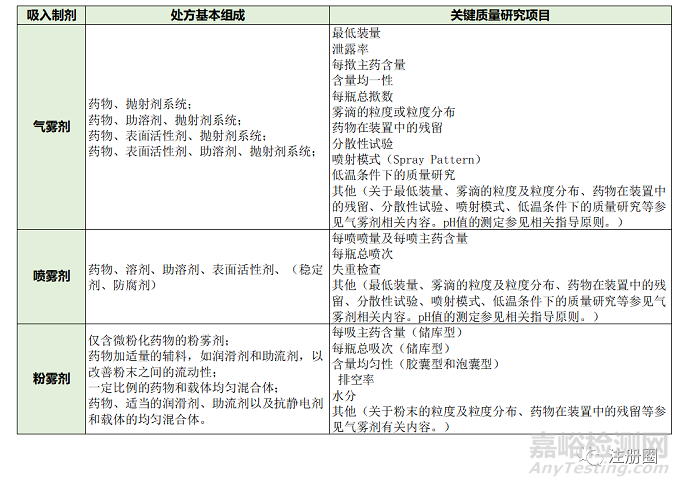
2. 中国(CDE)在参考国内外相关指导原则和文献的基础上,结合我国吸入制剂研发的现状,通过分析质量控制研究与安全有效性和质量可控性之间的内在关系制定了《吸入制剂质量控制研究技术指导原则》,并于2007年颁布。该指导原则仅讨论了经口腔吸入制剂在质量控制研究工作方面的特殊研究内容,经鼻吸入制剂暂不纳入该指导原则(见表3)。
▲ 表3-《吸入制剂质量控制研究技术指导原则》
3. FDA于2022年颁布的指南草案《Nasal Spray and Inhalation Solution, Suspension, and Spray Drug Products — Chemistry, Manufacturing, and Controls Documentation》中除了详细介绍了鼻腔喷雾剂、吸入溶液、混悬液和局部或全身性治疗用喷雾药品的新药申请(NDAs)或新药简略申请(ANDAs)所需的质量研究和特性稳定的内容和资料,还额外指出了产品的容器包装系统需要进行的研究和应提交的资料:
储药罐、密封组件和组装泵生产厂家;
泵组件生产厂家;
各泵组件的识别号;
储药罐、密封组件和泵组件的工程图;
储药罐、密封组件和泵组件的精准尺寸;
储药罐、密封组件和泵组件的原料组成和质量;
橡胶和可塑料原部件的萃取物检查方法和数据;
萃取物毒理学评价数据;
可接受标准、测试过程和分析抽样设计;
储药罐、密封组件和泵组件的理化参数和外形尺寸;
储药罐、密封组件和泵组件萃取物的定性和定量情况;
泵的特性;
指南中还指出,对于存贮在半渗透性容器/密闭系统(如低密度聚乙烯,LDPE)中的吸入药品使用保护性包装(如铝箔袋),保护性包装可降低外源性污染、溶剂损失和有氧暴露。此外,这些药品的标签推荐使用压纹和击凹的形式,以避免其它类型标签(挥发性有机化合物油墨、纸张、黏合剂成分)潜在的渗入。应确定间接来自标签或相关材料暴露的可浸出物含量,使用经验证的方法(满足检测和定量限度)对各析出物进行测定,析出化合物的水平应经过确证和记录,建立相应可接受的标准。
鼻用喷雾剂
1. 中国关于鼻用喷雾剂的药学研究法规仅在《中国药典》中有所描述,在2020年版《中国药典》中,鼻用喷雾剂的质量除符合气雾剂项下要求外,还要符合鼻用制剂相关项下的要求。传统鼻腔喷雾剂的开发始终围绕着药典规定鼻用制剂质量控制的关键属性而展开: 为水性介质的鼻用制剂应调节pH值与渗透压;还有黏度、沉降体积比及再分散性( 混悬型) 和不溶性微粒( 混悬型) 。同时对鼻用喷雾剂具体的质量要求又做了细化规定: 要求对鼻用喷雾剂喷出后的雾滴粒子应大于 10 μm,以防止雾滴粒子进入肺部而被吸收,规定采用微细粒子空气动力学检查法,检查其微细粒子的剂量( 对乳液型雾滴进行雾滴粒子大小及均一性的检查) ; 对常用的多剂量型定量喷雾剂要求检查净含量、每瓶总喷次、每瓶喷量及每喷的主药含量; 对定量吸入型喷雾剂、混悬型及乳液型定量鼻用喷雾剂还应检查递送剂量均一性,以保证每次给药能够剂量均一; 药典附录规定的微细粒子空气动力学检查法,对分级测定微粒的粒径大小及预测体内分布有一定的意义。
2. usp<5>Inhalation and nasal drug products-general information and product quality tests中介绍了鼻用喷雾剂需要进行的质量研究测试,还提出需要进行usp<601>Inhalation and nasal drug products: aerosols, sprays, and powders-performance quality tests中的性能测试见表4。
▲ 表4-usp<5>、usp<601>
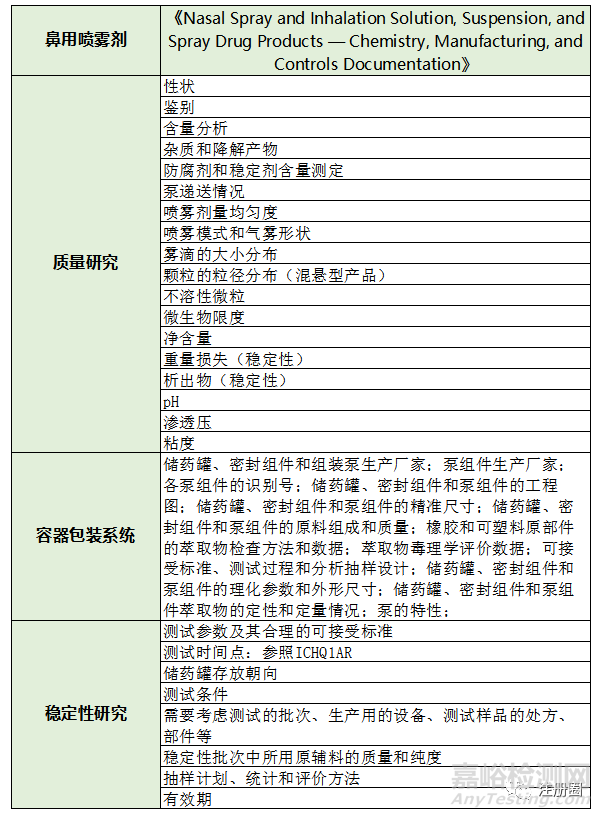
此外在FDA的指南草案中《Nasal Spray and Inhalation Solution, Suspension, and Spray Drug Products — Chemistry, Manufacturing, and Controls Documentation》对鼻用喷雾制剂的药学研究进行了详细的介绍,从原料药、处方组成、辅料到质量研究、稳定性研究,还有容器包装系统都一一进行了描述(见表5)。该指南草案除了提到《中国药典》里需要进行的质量研究项目外,还提出了鼻用喷雾制剂的关键部件——泵,需要对其性能进行研究,因为鼻用喷雾制剂产品的剂量直接取决于泵的设计,此外泵与储药罐、密封部件和处方成分的相容性都应该彻底地调查和研究。
▲ 表5-《Nasal Spray and Inhalation Solution, Suspension, and Spray Drug Products — Chemistry, Manufacturing, and Controls Documentation》
吸入制剂的中美考量
通过上述对中美关于吸入制剂法规的介绍,可以看出FDA除了关注吸入制剂的质量研究之外,同样关注吸入制剂使用到的装置、包装系统,中国对于这块的法规还是有所缺失的。此外FDA还明确给出了吸入制剂的稳定性研究需要考察的因素,不仅限于ICHQ1中的稳定性研究项目,还额外提出了针对吸入制剂特性的稳定性测试。由于吸入制剂大多需要匹配给药装置来进行给药,迄今为止,中国研发的各类吸入制剂均按药品申报注册;而FDA对于部分吸入制剂是按新剂型(new dosage form)和新组合(new combination)批准上市,比如上文介绍到的盐酸艾司氯胺酮鼻喷雾剂,在中国以化学药品第5类申报上市,而在FDA(2019)是作为新剂型(new dosage form)和新组合(new combination)申报上市。总体来看,中国药企对于吸入制剂的药学研究要点可以参考FDA出台的相关法规和指南草案,再结合中国的法规要求来进行注册申报。
小结
正因吸入制剂可将药物直接递送到呼吸道和肺部,无首过效应,生物利用度高,可明显提高患者的依从性,而在药物治疗中正发挥着越来越重要的作用,并成为治疗支气管哮喘(Asthma)和慢性阻塞性肺疾病(COPD)的首选给药途径。通过吸入制剂的药学法规来看,吸入制剂的研发应聚焦于关键辅料、给药装置、包装材料以及特性分析检测等方面,确保最终药品的安全性和有效性。