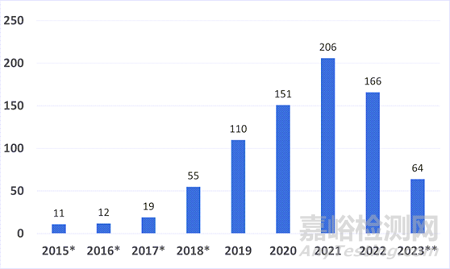
自2015年启动突破性医疗器械计划到截至发文时间,FDA已授予794个突破性医疗器械称号,其中786个来自CDRH,8个来自生物制品和评估中心(Center for Biologics Evaluation and Research,简称:CBER)。
图 按财政年度划分的突破性设备称号数量
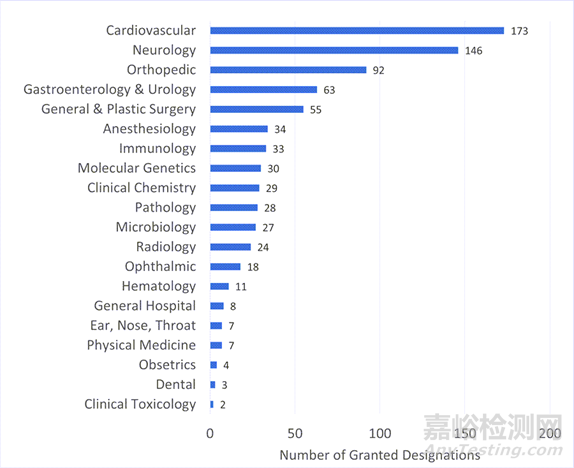
从突破性器械认定结果来看,心血管类器械获得认定数量最多。心血管类器械以173个认定数量领先,而神经病学小组以146个紧随其后。其他获得突破性认定的器械包括骨科、消化内科和泌尿外科、普通外科和整形外科等。
图 按临床小组授予的突破性设备数量
FDA的“突破性设备”事实上代表了全球医疗器械创新的顶尖水平。不过,入选“突破性设备”名单之后,距离真正获批上市还有一段距离。根据美国“突破性医疗器械计划”,截止2023年3月31日,共有67项上市许可,包括65个CDRH设备和2个CBER设备。
2022年全年共有19款“突破性设备”最终获准上市。

FDA:19个设备获得“突破性医疗器械”市场授权!如何才能获得FDA的“绿色通道”?
2023年,截至到发文时间为止,共有5款“突破性设备”最终获准上市。
1、产品名称:RADIOTHERAPY SYSTEM(生物引导放射疗法)
公司名称:RefleXion Medical
产品介绍:
RefleXion Medical Radiotherapy System(RefleXion医疗放疗系统)是RefleXion公司于2022年2月2日获批De Novo的医疗器械产品。RefleXion是一家致力于研发生物引导放射疗法(BgRT) 的癌症治疗公司,曾研发出全球第一台生物引导放射治疗设备RefleXion X1。RefleXion 的 SCINTIX ™生物引导放射疗法获得 FDA 批准,这是一种适用于早期和晚期癌症的尖端疗法。该技术嵌入到RefleXion Medical的X1机器中,所采用的是PET引导的放射治疗,不仅能够实时跟踪多个肿瘤的运动,甚至在患者呼吸、消化和移动时也能正常发挥作用,同时还能在最大限度地减少对周围解剖结构的损害。
除了首次获得FDA批准外,Scintix系统还获准与最常见的PET示踪剂——氟脱氧葡萄糖F18(fluorodeoxyglucose F 18)一起使用。谈到未来计划,RefleXion Medical表示,他们目前正计划对该技术进行调整,以期与更广泛的放射性药物协同工作,而所有这些药物都能更好地对各种类型的癌症作出反应。
2、产品名称:实验室创伤性脑损伤(TBI)血液测试
公司名称:Abbott(雅培)
产品介绍:
临床脑震荡评估标准一直未曾改变,其临床医生都是利用格拉斯哥昏迷评分(Glasgow Coma Scale)和CT扫描来检测脑组织损伤或病变。进行血液检测则有助于将不必要的CT扫描次数减少至40%,从而可能降低医疗保健系统和患者的成本以及他们在就诊室所花费的时间,以免耽误最佳治疗。实验室创伤性脑损伤(TBI)血液测试是首个商业可用的实验室创伤性脑损伤(TBI)血液测试,使其在美国医院广泛使用。这项测试在雅培的Alinity®i实验室仪器上运行,将为临床医生提供一种客观的方法来快速评估轻度TBI(也称为脑震荡)患者。
3、产品名称:ReWalk™ Personal 6.0 外骨骼机器人
公司名称:ReWalk
产品介绍:
ReWalk Personal系统使设备用户能够坐、站、走、转身,并能够上下楼梯。ReWalk 用户可以独立操作系统。ReWalk Personal于2014 年获得了 FDA 的上市许可。它是美国第一个获得此许可的外骨骼。电池供电的系统具有轻便、可穿戴的外骨骼,在髋关节和膝关节处装有电机。ReWalker 使用其重心的细微变化来控制运动。系统感测到上身的前倾,开始第一步。重复的身体移动会产生一系列模仿腿部功能性自然步态的步骤。

4、产品名称:RemeOs™ 创伤螺钉
公司名称:Bioretec公司
产品介绍:
RemeOs™ 由独特的专利生物可吸收金属合金制成,由镁、钙和锌组成,都是人体新骨形成的必需元素,Zn含量的组成可以控制降解吸收的速度。值得注意的是,RemeOs™ 不含任何对人体有害的材料,如钇、钆、钕或任何其他稀土元素 (REE)。RemeOs™ 创伤螺钉可以通过患者身体的自然愈合过程被新骨吸收和替换,无需在骨折和骨骼愈合时进行植入物移除手术。RemeOs™ 创伤螺钉获得了FDA授予的突破性器械称号,这不仅验证了该产品的优势,也进一步表明美国市场需要传统金属植入物的真正替代品。

5、产品名称:MASIMO SAFETYNET OPIOID SYSTEM(阿片剂量监测系统)
公司名称:MASIMO迈心诺医疗
产品介绍:
阿片类药物是从阿片(罂粟)中提取的生物碱及衍生物,能缓解疼痛,但长期服用可上瘾。该产品是业内第一个通过 FDA 批准的阿片剂量监测系统,主要用于检测阿片类药物引起的呼吸抑制。它与分布式架构相结合,可以发送警报给患者及其家人、朋友和护理人员。当Opioid Halo认定患者已经服用过量阿片类药物且可能需要帮助时,将自动触发可能导致派遣EMS(Emergency Medical Services,紧急医疗服务)的自动健康呼叫。
什么是“突破性设备计划”?
突破性设备计划(Breakthrough Devices Program) 是美国食品药品监督管理局(FDA)于2015年4月启动的一种加快医疗器械开发和审查过程的“绿色通道”,让患者能尽快获得有效诊断或可治疗危及生命疾病的医疗器械。
被FDA纳入“突破性设备计划”有什么好处?
FDA将被授予“突破性医疗器械”称号的产品提供有关设备开发、临床试验方案的优先权审查、FDA审核团队支持以及产品商业化决策的交流服务。此举可以大大推动创新医疗器械的上市过程。