今日头条
诺诚健华TYK2抑制剂Ⅱ期临床积极。诺诚健华新型酪氨酸激酶2(TYK2)抑制剂ICP-332治疗中重度特应性皮炎(AD)的Ⅱ期临床达到主要终点。与安慰剂相比,ICP-332(80m、120mg)每日一次治疗组患者的EASI(湿疹面积和严重程度指数)评分较基线的平均百分比变化显著更高(78.2%和72.5%,vs16.7%),达成EASI 75应答的患者比例更高(64%和64%,vs8%)。此外,药物耐受性良好。
国内药讯
1.罗氏眼科双抗中国获批上市。罗氏眼科注射双特异性抗体法瑞西单抗(商品名:罗视佳®,Vabysmo®)获国家药监局批准上市,用于治疗糖尿病黄斑水肿(DME)。这是全球首个双通路眼底创新治疗药物,同时靶向抗血管生成素-2(Ang-2)和血管内皮生长因子A(VEGF-A)的双重作用机制。在美国,该产品目前已获批DME、湿性年龄相关性黄斑变性(wAMD)和视网膜静脉阻塞继发黄斑水等适应症。
2.AZ创新止血疗法中国报产。阿斯利康与百特公司申报的3.1类生物制品注射用andexanet alfa(AndexXa)的上市申请获CDE受理。andexanet alfa是一款凝血因子Xa抑制剂逆转剂,能够快速逆转因子Xa抑制剂rivaroxaban和apixaban的抗凝血作用,控制严重和不可控制的出血。今年6月,阿斯利康宣布Andexxa在上市后IV期试验(ANNEXA-I)中期结果中达到止血优效性标准,并提前终止该项研究。
3.信达HER3-ADC上实体瘤临床。信达生物靶向HER3的ADC新药IBI133在Clinicaltrials.gov网站上注册一项Ⅰ期临床,计划在澳洲评估IBI133用于治疗晚期实体瘤患者的安全性与有效性。该项试验预计2025年底初步完成。目前全球范围内尚未有靶向HER3的疗法获批上市。目前,信达生物已有5款ADC进入临床阶段,分别为CEACAM5 ADC(赛诺菲引进)、Claudin18.2 ADC、HER2 ADC、Trop2 ADC和HER3 ADC。
4.九天生物SMA基因疗法上I期临床。九天生物AAV基因治疗药物SKG0201注射液获国家药监局批准开展I期临床,拟评估用于治疗I型脊髓性肌萎缩症(SMA)的安全性与有效性。SKG0201包含由独特启动子调控并全面优化的人源SMN1 cDNA。临床前数据表明,SKG0201单次静脉注射不仅可快速、持久地恢复功能性SMN蛋白表达,而且在低剂量水平下即可显著增加SMA疾病模型小鼠的体重并有效地延长其寿命。
5.礼来IL-13抗体中国获批临床。礼来1类生物制品lebrikizumab注射液(Ebglyss)获国家药监局临床默示许可,拟开发用于治疗中重度特应性皮炎(AD)青少年和成人患者。lebrikizumab是Almirall公司与礼来联合开发的IL-13抑制剂,通过与IL-13结合,以阻止IL-13Rα1/IL-4Rα异二聚体复合物的形成以及后续信号传导。今年11月,欧盟委员会已批准Ebglyss上市,用于治疗12岁及以上中重度特应性皮炎患者。
6.优诺DC细胞疗法获批胰腺癌临床。广东优诺生物UNODC0407注射液获国家药监局临床试验默示许可,拟开发用于治疗不可手术切除的局部进展期胰腺癌或转移性胰腺癌。UNODC0407是利用肿瘤抗原对患者自体树突状细胞(DC)进行特异性免疫刺激培养的一款肿瘤治疗性疫苗。它通过DC将肿瘤匿名抗原呈递给效应性淋巴细胞,从而诱导更有效的肿瘤免疫反应并杀伤肿瘤细胞。
国际药讯
1.DMD类固醇新药获欧盟批准上市。Santhera公司类固醇药物AGAMREE®(vamorolone)获欧盟(EU)批准上市,用于治疗4岁及以上患者的杜氏肌营养不良症(DMD)。在IIb期临床(VISION-DMD)中,vamorolone的疗效与强的松相比达到非劣效标准;而且并未发现vamorolone在骨骼健康生物标志与线性生长上有负面的影响。在中国,曙方医药拥有该产品在大中华区开发和商业化的独家权益。
2.全球首款CRISPR基因疗法获欧盟支持上市。Vertex公司与CRISPR Therapeutics开发的CRISPR/Cas9基因编辑疗法Casgevy(exa-cel)获欧洲药品管理局(EMA)人用药品委员会(CHMP)推荐有条件批准上市。这是全球首款CRISPR基因编辑疗法,FDA已于12月8日批准Casgevy上市,用于治疗12岁及以上患有复发性血管闭塞危象(VOC)的镰刀型细胞贫血病(SCD)患者。据媒体报道,该产品每位患者的治疗费用高达220万美元。
3.肿瘤mRNA疫苗联合K药3年随访数据积极。默沙东与Moderna开发的肿瘤新抗原mRNA疫苗V940(mRNA-4157)联合PD-1抑制剂Keytruda治疗完全切除的高危黑色素瘤(III/IV期)患者的IIb期KEYNOTE-942/mRNA-4157-P201研究最新结果积极。中位随访为3年时,V940组合辅助治疗较Keytruda持续改善患者的无复发生存期(RFS),将复发或死亡风险降低49%(HR=0.510 [95%CI:0.288-0.906];P=0.0095);将发生远处转移或死亡的风险降低62%(HR=0.384 [95%CI:0.172-0.858]; p=0.0077)。该研究中V940的安全性与之前报告一致。
4.GLP-1基因疗法减重临床前研究积极。Fractyl Health公司开发的基因疗法GLP-1 PGTx在治疗肥胖症的临床前研究中获积极结果。与司美格鲁肽(10 nmol/kg/day)治疗相比,小鼠肥胖模型单剂输注GLP-1 PGTx后28天,小鼠体重降幅显著更多(27%vs21%);在小鼠停用司美格鲁肽之后接受单剂GLP-1 PGTx或安慰剂治疗,转为接受GLP-1 PGTx治疗的小鼠体重降幅较基线达到26%,而转为接受安慰剂的小鼠体重增加19%。该公司计划明年进行IPO,以推进GLP-1 PGTx的临床开发。
5.眼科补体C3疗法未获欧盟支持上市。Apellis公司靶向C3补体蛋白的聚乙二醇化(PEGylated)双环肽疗法pegcetacoplan(Syfovre)的上市许可申请(MAA)未获得欧洲药品管理局(EMA)人用药品委员会(CHMP)支持,以用于治疗年龄相关性黄斑变性(AMD)继发地理性萎缩(GA)。发表在《柳叶刀》上的Ⅲ期(OAKS和DERBY)研究数据显示,每隔一个月和每月一次的Syfovre治疗均能显著减少GA病变的生长。今年2月,FDA已批准Syfovre用于治疗由AMD引起的地图样萎缩(GA)。
6.AI小分子药物公司Deep Apple完成A轮融资。人工智能(AI)小分子药物公司Deep Apple宣布完成5200万美元的A轮融资,以用于推进GPCR调节剂开发,应用于代谢紊乱、炎症、免疫学和内分泌疾病。Deep Apple利用其冷冻电镜技术、深度学习和超大型分子对接筛选文库,能够在12个月内完成从靶标识别到先导物优化。Deep Apple的发现引擎适用于广泛疾病领域,尤其适合针对完整膜蛋白的加速发现。
医药热点
1.广东省全面启动加速消除宫颈癌行动。12月13日,广东省卫健委公布《广东省加速消除宫颈癌行动计划(2023—2030年)》,明确了2030年前完成三大目标:持续推进适龄女孩HPV疫苗接种服务,15岁之前适龄女生HPV疫苗首针接种完成率达到90%;35—64岁妇女宫颈癌筛查率达到70%;确诊宫颈癌及癌前病变患者治疗率达到90%。
2.瑞金医院卢湾分院帕金森病诊疗中心成立。12月15日,上海交通大学医学院附属瑞金医院卢湾分院“帕金森病卓越诊疗中心”正式揭牌。瑞金医院卢湾分院脑病中心主任陆勇表示,帕金森病卓越诊疗中心以创新技术群和医疗新模式为先导,为帕金森病患者提供高效、全面的一站式服务,旨在有效减轻患者的残疾症状、提高生活质量,通过数字化智能及互联网技术赋能居家医疗,实现全流程智能化服务。
3.北大医院大兴院区正式启用。12月18日,北京大学第一医院大兴院区正式启用。北大医院大兴院区距离中心院区直线距离约22公里,建有门诊楼、医技楼、急诊楼、住院楼、科研楼、行政教学楼,占地面积21.6万平方米,编制床位数1200张,其中儿科床位400张、妇产科床位200张、其他综合床位600张。大兴院区开办将以“先门诊、后病房,先平台、后临床,先专科、后综合”的基本步骤实施,以“大专科、小综合”进行学科布局,与中心院区差异化发展。
评审动态
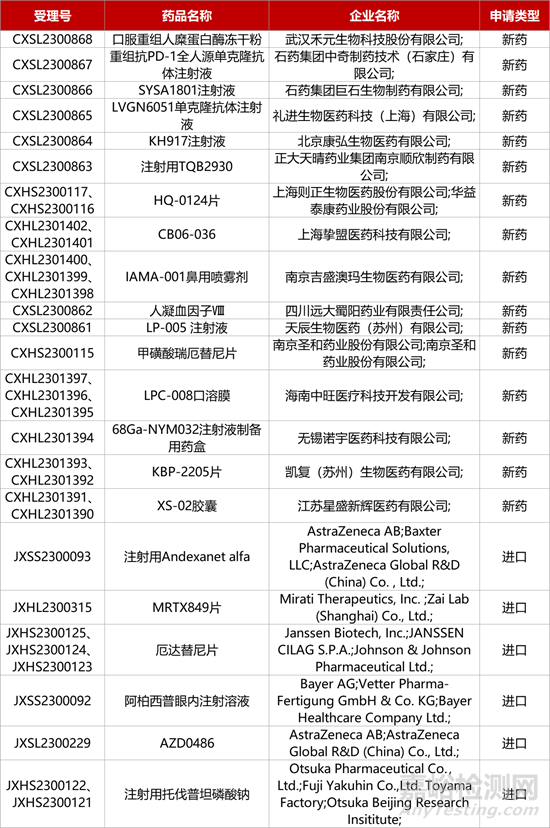
1. CDE新药受理情况(12月16日)
2. FDA新药获批情况(北美12月15日)