您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-06-13 20:36
前言
研发新药往往需要新颖的化学结构,而新颖的化学结构需要新颖的结构片段。近几十年来,新兴化学元素——硼逐渐步入大众视野,科学家们通过在药物分子中引入硼(B)元素获得新颖的分子结构。目前含硼药物在抗炎、抗菌、抗肿瘤等方面已取得了一系列令人瞩目的成果。迄今为止,全球已有5个含硼药物被批准上市,处于临床试验阶段的含硼药物也不在少数,同时不断有新的含硼化合物在相关研究中被发现,扩展了硼在药物研发领域的应用,为新药研发带来了新的思路和希望。本文将介绍硼元素的特性、硼在药物设计和新药研发中的应用以及研发过程中需要关注的部分。
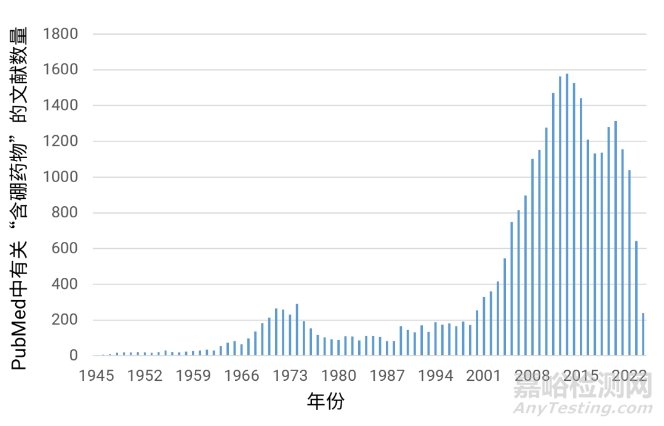
图1. PubMed中有关“含硼药物”的文献数量
含硼药物的研究进展
2003年第一个含硼药物硼替佐米的成功上市,极大地激发了研究人员对硼元素在新药研发中的信心及兴趣。迄今为止,全球已有5款含硼药物获批上市(图2)。
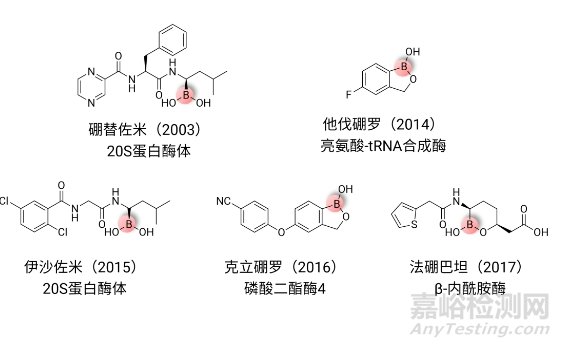
图2. 已上市的含硼药物
除了已上市的含硼药物,还有许多处于临床、临床前或生物活性研究阶段的含硼药物。这些药物在多种疾病的治疗领域,特别是抗癌、抗病毒、抗菌等方面表现出巨大的潜力(表1)。
表1. 截至2023年全球处于临床研究阶段的部分含硼药物[1]
硼和含硼基团独特的理化性质
硼元素在药物设计中的应用与其独特的物理、化学性质密切相关。硼的原子序数为5,价电子轨道为2s22p1,拥有一个空的p轨道,具有较强的亲电性。这一亲电特性使硼原子易与蛋白、酶等生物分子的巯基、羟基和氨基结合。同时,硼原子可以在平面三角sp2和四面体sp3杂化状态之间相互转换,因此有机硼化合物可与靶标分子形成多种作用模式(图3)[2]。利用该性质,硼在可逆共价抑制剂开发方面发挥了重要作用。
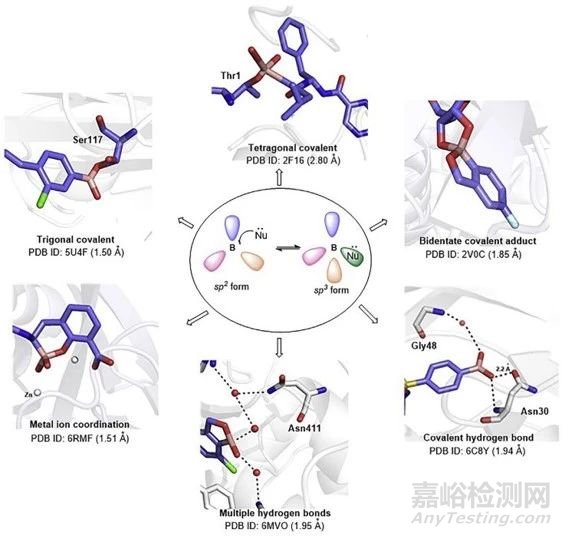
图3. 有机硼化合物与生物靶点的相互作用模式[2]
硼酸基(R-B(OH)2)是硼在有机分子中最常见的形式,下面以硼酸基为例介绍含硼基团的特性。多项研究表明硼酸基是羧酸、磷酸等多种基团的生物电子等排体。硼酸pKa较高,通常在7-9之间。在生理pH下,硼酸基处于非电离的状态(图4)。基于这些特性,利用硼酸基对药物分子进行官能团替换或结构修饰,可有效改善药物性质。
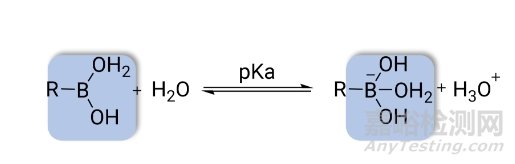
图4. 硼酸在水溶液中的电离状态
硼在药物分子设计中的优势和应用
硼在药物分子设计中的优势
由于硼和硼酸基团具有独特的理化性质,硼在药物分子设计中表现出显著的优势,其已经被广泛应用于药物化学领域[3]。
1、提高药物活性和选择性
在第一个含硼药物硼替佐米(Bortezomib)的研发路程中,科学家们首先开发了醛基多肽类蛋白酶体抑制剂,然而由于其抑制活性较差,选择性不高,生物利用度较低等缺陷,需要对其进行结构优化。科学家们用硼酸基替换分子中的醛基,发现了抑制活性显著提高的化合物——硼替佐米。
当硼替佐米与20S蛋白酶体结合时,分子中的硼原子与附近残基Thr1的羟基形成可逆的共价键,同时硼酸基游离的两个羟基分别与Thr1和Gly47的氨基形成氢键,帮助稳定了蛋白与化合物形成的复合物(图5)。与先导化合物相比,硼酸基的引入显著提高了化合物的抑制活性。同时,硼不易与半胱氨酸蛋白酶如组织蛋白酶B的巯基发生结合,这也使硼替佐米对蛋白酶体有了独特的选择性。最终,硼替佐米从多个待选化合物中脱颖而出,成功上市。
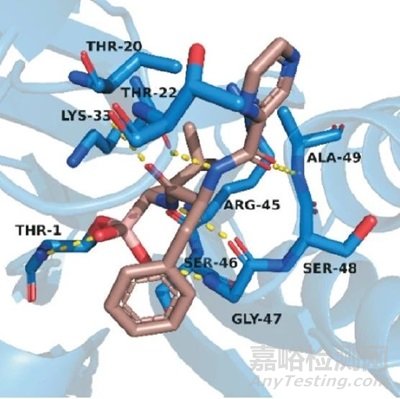
图5. 硼替佐米(棕色)与20S蛋白酶体(蓝色)的结合模式(PDB:5LF3)[1]
2、改善药物药代动力学性质
除提高药效外,科学家还通过引入含硼基团改变化合物logP和logD,改善药物的药代动力学性质。Yali Kong等人[4]用硼酸基取代酚羟基,提高了化合物的溶解度;Harald等人[5]在化合物中用将羧基替换为硼酸基,提高了化合物的细胞膜穿透性,增强了化合物的抗病毒活性。
除此之外,还可以在代谢软点上引入硼或者含硼基团,提高化合物血浆暴露量。氟维司群(Fulvestrant)是FDA唯一批准的选择性雌激素受体下调剂,其临床上重要的一个缺陷就是血浆暴露量极低。研究表明,给药后,氟维司群的3’酚羟基在体内会快速与葡萄糖醛酸和硫酸结合,生成极性大的二相代谢产物,迅速地排出体外。Liu等人[6]用硼酸取代了酚羟基合成了ZB716(图6)。ZB716不仅很大程度保留了氟维司群的药理学活性,同时由于阻断了葡萄糖醛酸和硫酸的结合位点,提高化合物的代谢稳定性,显著提高了药物血浆暴露量。且ZB716在体内可氧化代谢生成氟维司群,硼酸的引入还可以降低氟维司群的清除速度。目前ZB716正处于临床前开发阶段[7]。
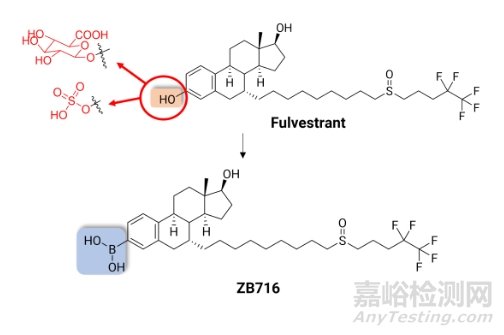
图6. 氟维司群及其衍生物ZB716结构
硼在药物研发中的主要应用
随着硼的应用范围不断扩大和科学家对硼认识的加深,近些年硼在药物化学、药物输送、生物材料等方面均受到关注。接下来本文将介绍硼在药物研发中的主要应用。
1、可逆共价抑制剂
硼原子易与生物分子形成可逆的共价结合,因此硼也常用于共价可逆抑制剂的开发。严格来说,已经上市的硼替佐米、伊沙佐米和处于临床研究阶段的VNRX-5133(Taniborbactam)等药物均是含硼原子的共价可逆抑制剂。
随着共价抑制剂在药物研发领域中蓬勃发展,相信硼在这类新药研发中可以获得更大发挥的平台。
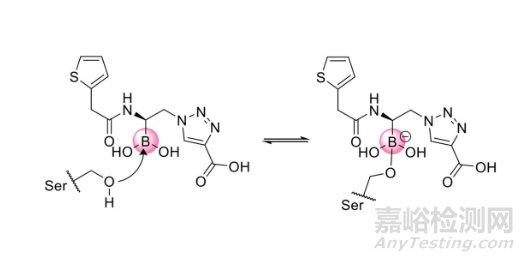
图7. 含硼药物与靶标形成的可逆性结合[8]
2、ROS选择性激活前药
含硼药物中的硼原子有一个空的p轨道,对活性氧(ROS)敏感,容易受到亲核物质如H2O2的进攻。正常情况下,细胞中ROS保持在较低水平;但在一些特殊环境如肿瘤、炎症细胞中,由于病理因素导致ROS浓度会显著提高。科研人员利用硼原子对ROS敏感的特性,设计了能被ROS选择性激活的含有硼基团的前药,靶向地将药物递送到相应部位发挥药效。
SN-38(图8)——喜树碱(CPT)的衍生物,是拓扑异构酶I抑制剂,对多种恶性肿瘤有疗效,如HER2阳性乳腺癌和三阴性转移性乳腺癌等。Lei Wang等人[9]用硼酸基替换了SN-38分子中的药效基团酚羟基,设计ROS选择性激活前药B1。前药B1成功在肿瘤细胞系MCF-7、U251及HT-29中释放出活性分子SN-38,并且其释放水平与H2O2呈现浓度依赖性。除此之外,在体内抗肿瘤实验中,前药B1在小鼠体内同样表现出很好的抗肿瘤活性,与阳性药(伊立替康)组相比,疗效相当并且未观察到明显的毒性及过敏反应。这些实验结果表明基于硼设计的前药B1不仅具有较好的药效,还具有更高的安全性。
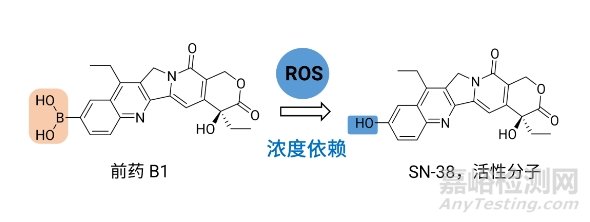
图8. ROS选择性激活前体药物B1释放活性分子SN-38[9]
3、硼修饰多肽靶向药物
随着研究的深入,除了在常规小分子中的应用之外,近些年硼也被证明在多肽类药物研发中具有巨大潜力。在一些多肽类药物分子中引入硼原子,可提高其与靶标的亲和力和选择性,从而提高药物的疗效。硼元素可成为多肽类药物研发中的一种重要工具和策略,有望为多肽类药物的开发和应用提供新的思路和方法。
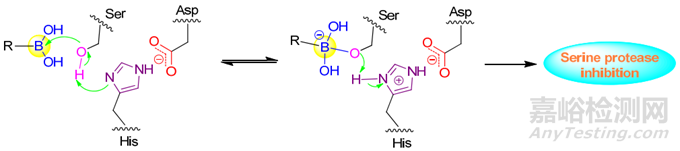
图9. 硼酸修饰多肽对丝氨酸蛋白酶的抑制机制[10]
含硼药物的药代动力学(DMPK)特征及其代谢研究考量
前文已经介绍了硼的性质,基于硼的特性硼在新药研发中得到广泛地应用,但同样因为这些特性也使含硼药物在安全性和药代动力学方面存在一些未知和挑战。接下来本文将介绍含硼药物DMPK特征及其代谢考量。
1、DMPK特征
由于硼酸基或含硼基团具有较高的pKa,硼修饰的药物可改变化合物的膜穿透性,改善药物吸收,因此常开发为口服药物。目前多个处于临床研究阶段的含硼药物如度格列汀、阿考硼罗、GSK3036656等均表现出较好的口服生物利用度。大部分已上市或处于临床研究阶段的含硼药物具有较大的分布容积。硼易与生物分子结合,含硼药物进入体内后可能会与其他内源性亲核靶标发生非特异性反应,产生脱靶效应,引起药物的不良反应。这也使对于新的含硼化合物研究人员需要特别关注药物体内的分布情况。在代谢方面,含硼药物在体内主要通过细胞色素P450酶系发生代谢,主要代谢途径是氧化脱硼反应[11]。值得注意的是含硼基团对ROS敏感,部分含硼药物在体内会与ROS反应,并且这种反应与ROS浓度相关。在排泄方面,含硼药物主要通过原型药或代谢产物经肾排出体外。
2、含硼药物代谢研究考量
在药物早期发现阶段,常用体外代谢实验评估药物代谢情况。而在常规的体外代谢模型如肝微粒体、肝细胞中ROS水平较低,利用这些体外代谢体系的结果不能较全面地预测含硼药物在体内,特别是患者体内的代谢情况。因此为更准确评价含硼药物代谢,预测药物体内代谢情况,可建立特殊的体外研究模型。
含ROS的缓冲液体系
将含硼化合物与不同浓度的ROS缓冲液反应,对反应后的溶液中含硼化合物的产物进行定性及定量分析,可有效评价ROS对相应含硼药物的代谢影响。
以硼替佐米为例,将硼替佐米置于含H2O2缓冲液孵育4h,实验结果如图10A。在H2O2的作用下,硼替佐米会发生氧化脱硼酸反应,生成产物M1和M3,并且随着H2O2浓度的增加,硼替佐米含量不断减少,相应产物含量也不断增加,产物含量与H2O2呈现浓度依赖性。
硼替佐米在人肝微粒体孵育样品中,除母药硼替佐米外,可以检测到代谢产物M1/M2(非对映异构体),以及一系列相关次级代谢物。与微粒体结果相比,在H2O2作用下硼替佐米发生氧化脱硼酸,也可生成M1和M3,且M1和M3的相对丰度总和超过70%,这一结果表明ROS介导的氧化脱硼反应在含硼替佐米代谢过程中发挥着不可忽视的作用。基于人肝微粒体和H2O2缓冲液的实验结果,硼替佐米的代谢途径如图10B。
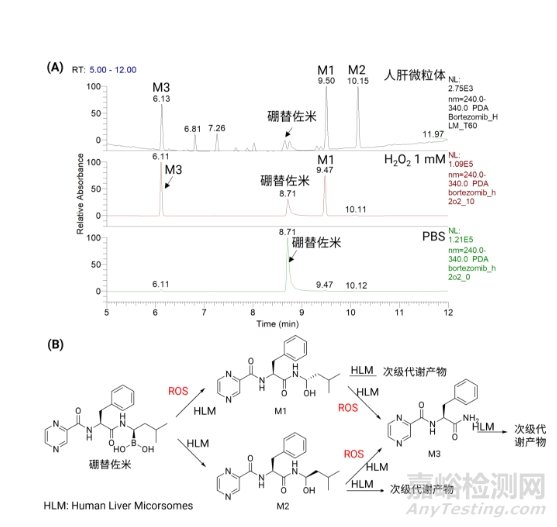
图10.(A)硼替佐米及其产物在不同基质样品中的LC-UV(λ=240-340 nm)图;(B)硼替佐米代谢途径
肿瘤细胞体系
将含硼化合物加入高ROS表达的肿瘤细胞(如MCF-7细胞系)体系中孵育,对其代谢产物进行鉴定分析,可对高ROS水平细胞中含硼药物(特别是基于硼设计的前药)的代谢情况进行评估。
结语
本文主要介绍了硼和含硼基团的性质、硼在药物设计和药物研发中的潜力以及含硼药物DMPK特征及代谢研究考量。虽然目前已上市含硼药物的数量不多,但其特殊的理化性质吸引着越来越多的药物研发人员进入相关研究,近些年越来越多与含硼化合物相关研究也证明这类药物的优势。在含硼药物研发过程中,需要特别关注其给药后在体内的分布情况;在对含硼化合物代谢进行评估时,不可忽视ROS对含硼药物代谢的影响。除常规的体外代谢模型外,可采取本文中提到的一些特殊体外代谢模型以更全面预测药物体内代谢情况,助力含硼药物研究。
参考文献:
[1] Du FH, Dong ZC, Chen LY, Huo WB, Li YL. Research progress of boron-containing drugs. J China Pharm Univ. 2023; 54(2):159–171.
[2] Song S, Gao P, Sun L, Kang D, Kongsted J, Poongavanam V, Zhan P, Liu X. Recent developments in the medicinal chemistry of single boron atom-containing compounds. Acta Pharm Sin B. 2021 Oct;11(10):3035-3059. doi: 10.1016/j.apsb.2021.01.010. Epub 2021 Jan 20. PMID: 34729302; PMCID: PMC8546671
[3] Silva MP, Saraiva L, Pinto M, Sousa ME. Boronic Acids and Their Derivatives in Medicinal Chemistry: Synthesis and Biological Applications. Molecules. 2020 Sep 21;25(18):4323. doi: 10.3390/molecules25184323. PMID: 32967170; PMCID: PMC7571202.
[4] Kong Y, Grembecka J, Edler MC, Hamel E, Mooberry SL, Sabat M, Rieger J, Brown ML. Structure-based discovery of a boronic acid bioisostere of combretastatin A-4. Chem Biol. 2005 Sep;12(9):1007-14. doi: 10.1016/j.chembiol.2005.06.016. PMID: 16183025.
[5] Albers HM, van Meeteren LA, Egan DA, van Tilburg EW, Moolenaar WH, Ovaa H. Discovery and optimization of boronic acid based inhibitors of autotaxin. J Med Chem. 2010 Jul 8;53(13):4958-67. doi: 10.1021/jm1005012. PMID: 20536182.
[6] Liu J, Zheng S, Akerstrom VL, Yuan C, Ma Y, Zhong Q, Zhang C, Zhang Q, Guo S, Ma P, Skripnikova EV, Bratton MR, Pannuti A, Miele L, Wiese TE, Wang G. Fulvestrant-3 Boronic Acid (ZB716): An Orally Bioavailable Selective Estrogen Receptor Downregulator (SERD). J Med Chem. 2016 Sep 8;59(17):8134-40. doi: 10.1021/acs.jmedchem.6b00753. Epub 2016 Aug 29. PMID: 27529700; PMCID: PMC5499704.
[7] https://classic.clinicaltrials.gov/ct2/show/NCT04669587
[8] Plescia J, Moitessier N. Design and discovery of boronic acid drugs. Eur J Med Chem. 2020 Jun 1;195:112270. doi: 10.1016/j.ejmech.2020.112270. Epub 2020 Mar 30. PMID: 32302879.
[9] Wang L, Xie S, Ma L, Chen Y, Lu W. 10-Boronic acid substituted camptothecin as prodrug of SN-38. Eur J Med Chem. 2016 Jun 30;116:84-89. doi: 10.1016/j.ejmech.2016.03.063. Epub 2016 Mar 24. PMID: 27060760.
[10] Tan Y, Wu J, Song L, Zhang M, Hipolito CJ, Wu C, Wang S, Zhang Y, Yin Y. Merging the Versatile Functionalities of Boronic Acid with Peptides. Int J Mol Sci. 2021 Nov 30;22(23):12958. doi: 10.3390/ijms222312958. PMID: 34884766; PMCID: PMC8657650.
[11] Labutti J, Parsons I, Huang R, Miwa G, Gan LS, Daniels JS. Oxidative deboronation of the peptide boronic acid proteasome inhibitor bortezomib: contributions from reactive oxygen species in this novel cytochrome P450 reaction. Chem Res Toxicol. 2006 Apr;19(4):539-46. doi: 10.1021/tx050313d. PMID: 16608165.

来源:药明康德


