您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-07-22 18:25
背景导读
2024年3月,新版 ISO 18562-2024系列标准“医疗应用中呼吸气体通路生物相容性评价”正式发布生效。
ISO 18562系列标准规定了医疗器械的气体通路进行生物相容性评价的要求和具体细节,适用于含有气体通路的医疗器械、部件或配件,如呼吸机、麻醉机、氧气浓缩器、雾化器、面罩、鼻氧管、呼吸管路系统、婴儿培养箱等。标准分为4个部分,包括ISO 18562-1风险管理过程中的评估和测试、ISO 18562-2颗粒物(PM)排放测试、ISO 18562-3有机挥发物(VOS)排放测试以及ISO 18562-4冷凝物中可沥滤物测试。
1、 ISO 18562评估程序
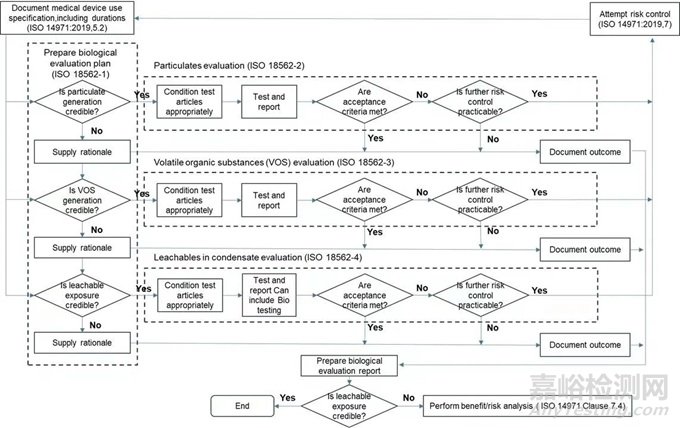
风险管理过程中生物相容性评估程序
A.风险管理过程中生物评估控制的一般原则
B.管路一般分类基于其与气流接触性质和持续时间
C.对所有来源的现有相关数据进行评估
D.在风险分析的基础上对可用数据的差距进行识别
E.对管路生物安全性分析的必要额外数据进行识别
F.管路生物安全性的评估
2、标准主要更新内容
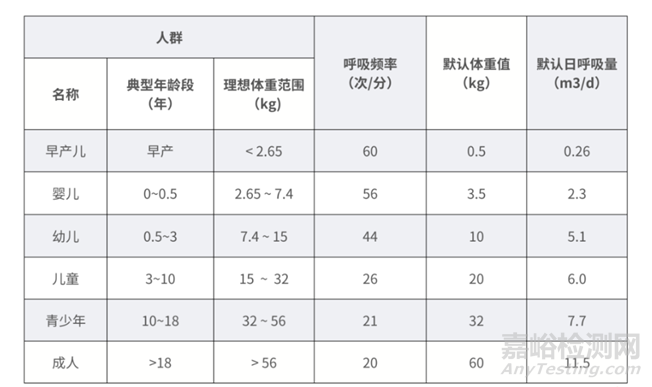
患者群体的更新
新生儿和儿科患者的体重很低,无法承受与成人相同剂量的有毒物质,需要专门针对这些体重较轻的患者计算相应的剂量。2024版新增且细分了人群,更新了不同人群的默认计算数值,具体见下表。
挥发性有机物的测试范围扩大
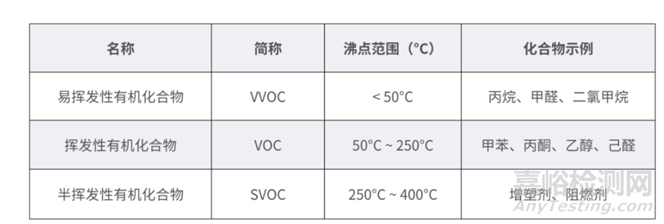
2017版中,18562-3对挥发性有机物(volatile organic compound, VOC)的测试范围定义在标准大气压下,沸点在50°C~260°C范围内的有机化合物。
而2024版打破了这一定义,需要测试的挥发性有机物(volatile organic substances, VOS)包括易挥发性有机物(VVOC)、挥发性有机物(VOC)和半挥发性有机物(SVOC),此外还需特别关注甲醛以及其它醛酮类化合物。
规定了挥发性有机物的测试细节
2024版详细规定了测试流速应当如何选择。对于有源医疗器械,例如呼吸机,选择最低的临床使用可设置流速,同时考虑流量、体积和压力,采样流速应小于器械流速的80%;对于无源医疗器械,例如鼻氧管,其流速取决于患者自主呼吸量,因此建议流速选择参考ISO 18562-1:2024中默认日呼吸量所对应的流速,且使用最小预期人群的对应参数。
为了最大限度地减少测试负担,对于测试终点的判定,建议在每种物质检出量低于可接受暴露量限值时,或释放趋势呈现下降趋势或没有增长趋势的平稳期时,可终止测试。
引入吸入剂量概念(inhalation dose)
通常挥发性有机物的实验室测试结果报告值为浓度,单位为μg/m3,然而,化合物的可接受剂量或限值通常以μg/d为单位,因此患者的吸入剂量需要通过患者日呼吸量(m3/d)进行计算,即化合物浓度乘以患者每天吸入的气体体积。计算时需考虑患者实际的吸入气体体积,而不是流经医疗设备呼吸通路的气体体积,例如睡眠呼吸机通常流量很大,但只有一部分进入患者的肺部。
冷凝水可沥滤物测试限度计算
2017版中,通过默认每日到达患者的冷凝水体积为1mL,将检出化合物浓度转化为每日暴露量。而2024版取消了这一默认体积,参考ISO 10993-18,以分析评价阈值(AET)作为检出物的报告限,对于检出浓度超过AET的化合物,计算其吸入或口服途径的可接受摄入量,评估其安全性。
3、 企业问答解疑
Q:正常使用过程中可能使用加湿气体的医疗器械,该如何评估颗粒物释放试验?
答:1. 根据 ISO 18562-1:2024中要4.3(c)表述如下:
正常使用可包括使用加热和加湿的呼吸气体。测试在“最坏情况”下进行。这可能意味着在有和没有加热及加湿的情况下进行测试以确定最坏情况。 加湿空气可能会影响挥发性有机化合物(VOS)和颗粒物的测量,因此需要在无加湿的情况下进行测试。
通常加湿空气会减少颗粒物释放,所以试验要在无加湿空气的条件下进行,如果产品本身正常使用过程中可能使用加湿气体,需要评估有和没有哪个是最坏情况,然后在最坏情况下获得数据。
2. ISO 18562-1:2024 5.2 b)1)中 颗粒物释放评估中气体通路中的水箱组件,需要在无水的环境下,按照ISO 18562-2:2024 标准进行评估。
Q:ISO 18562系列标准与ISO 10933系列标准的关系?
答:1. 根据 ISO 10993-1:2018 医疗器械分类5.1总体要求:对于仅与患者间接接触的气路器械组件,宜使用特定的医疗器械标准来进行相应类型的生物相容性评价需需要按照ISO18562系列标准评估。
2. 间接接触的气体管路材料与组织直接接触部分材料接受等同的测试,会导致过度的测试,或者导致可能的有害物质没有被检测到。
3. 在按照ISO 18562-1:2024评估中器械在临床使用过程中可能产生冷凝物,且冷凝物会到达人体,需要进行ISO 18562-4:2024冷凝物中可沥滤物的分析与评估。如果该器械、组件或配件已经按照ISO 10993系列标准评估,则ISO 18562-4:2024部分不需要额外测试。
Q:气体通路医疗器械构成中包含直接接触人体的部件如何进行生物相容性评估?
答:与气体通路相关的所有组件均需要按照ISO 18562系列标准评估,直接接触人体的部件还需要按照ISO10993系列标准评估。
Q:当按照ISO 18562-4:2024评估测试时,需要进行细胞毒评价该如何进行测试?
答:按照ISO 18562-4:2024评估,细胞毒评价的测试可以参考ISO 10993-5的测试,例如使用比较灵敏的MEM培养基进行。

来源:Internet


