您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-29 11:25
摘 要Abstract
本文回顾了监管沙盒的由来、发展及其特点;结合美国食品药品监督管理局(FDA)紧急使用授权,探讨紧急使用授权与针对金融科技的监管沙盒的相似性;同时简要介绍欧盟《通用药品立法》(提案)及英国药品和健康产品管理局(MHRA)推出的针对人工智能医疗设备的监管沙盒。医药产品监管沙盒不仅能为行业创新提供重要机会,还能为监管机构在创新技术、产品、服务或方法的早期开发阶段获得相关知识提供便利,使得监管机构跟上相关技术发展的步伐,进而有利于确定监管相关创新的最佳方法,并为相关法规的修订提供参考,也可能为上市批准带来更具适应性、灵活性的方法。
This paper reviews the origins, development, and characteristics of regulatory sandboxes. It explores the similarities between the FDA’s emergency use authorizations for medicinal products and the regulatory sandboxes used in the fintech sector. It also introduces the European Commission's General Pharmaceutical Legislation proposal and the AI Airlock, the regulatory sandbox for AIaMD, established by the UK's Medicines and Healthcare products Regulatory Agency (MHRA) for AI-driven medical devices. Regulatory sandboxes for medicinal products provide important opportunities for disruptive innovations in the industry, and offer regulators insights during the early development stages of new technologies, products, services, or methodologies. This approach helps regulators stay abreast of technological advancements, informs legislative options for regulatory reform, and potentially enables a more adaptive and flexible approach to marketing authorization.
关键词 Key words
监管沙盒;《通用药品立法》;紧急使用授权;颠覆式创新;监管灵活性;真实世界应用
regulatory sandbox; General Pharmaceutical Legislation; emergency use authorization; disruptive innovation; regulation flexibility; real-world application
2023 年4 月, 在三度推迟发布之后, 欧盟委员会发布有争议的欧盟《通用药品立法》(The General Pharmaceutical Legislation,GPL)(提案),预期GPL(提案)将重塑欧盟制药业的监管体系,并确定制药行业未来的发展方向。GPL(提案)首次提议以立法的形式规定建立医药产品监管沙盒。依据GPL(提案),作为创建有竞争力的监管框架的组成部分,欧洲药品管理局(EMA)将使用监管沙盒来测试真实世界条件下针对新疗法的新监管方法。监管沙盒在某些条件下可以与一个适用的框架联系起来,在不降低质量、安全和疗效标准的前提下,根据具体情况,尤其是新型药品固有的特点或方法进行调整[1-2]。
1、 监管沙盒的由来与发展
沙盒的概念最初来自于软件行业,沙盒软件能够让信息技术(IT)专业人士和开发机构在机器上创建一个沙盒,或者创建一个云端虚拟沙盒[ 又称为“容器”(container)],以隔离具有潜在风险的应用程序,顺利开展测试和开发工作。安装在沙盒环境中的软件保持“沙盒”状态,与主机分开运行。沙盒是暂时的,当沙盒关闭时,沙盒中的所有软件、文件和状态都会被删除[3-4]。以开源应用容器引擎Docker 容器为例,开发者可以统一方式将应用、依赖包打包到一个可移植的容器中, 然后可以发布到所有安装Docker 引擎的服务器上,实现虚拟化。Docker 容器完全使用沙盒机制,相互之间没有接口;几乎没有性能开销,易于在机器和数据中心中运行;不依赖任何语言、框架或系统[5]。
监管沙盒这一术语最初出现在金融科技(financial technology)背景下。针对不断涌现的金融科技创新,全球多个金融监管机构开展了监管沙盒实验,即采用监管沙盒模式,鼓励开发机构与监管机构合作,在常规的审评审批范式之外,在设定的安全护栏内,在真实世界环境中对新技术开展测试,生成并共享相关信息,如图1 所示。
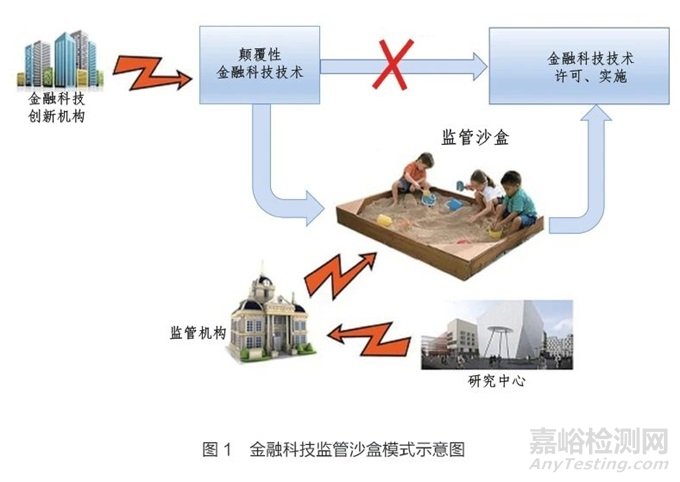
2015 年,英国金融行为监管局( Financial Conduct Authority,FCA)首次提出监管沙盒的概念,为开发机构提供一个“安全空间”,相关企业可以在其中测试创新产品、服务、商业模式和支付机制,且不会立即引起真实世界情况下的监管结果[6]。包括比特币在内的各种金融科技的快速扩张和超常需求成为FCA 推出这一计划的直接推动力[7]。监管沙盒提供一个独立、具备安全护栏的实验环境。监管机构可以在沙盒中调整法规,评估监管变化的影响,然后使用这些数据制定最终政策[8]。开展监管沙盒实验的要素包括:实验数据采集;基于产业投入的结构;更为广泛的技术迭代灵活性;在真实世界环境中部署;对范围、使用和持续时间的限制。监管沙盒要求在一个设立安全护栏的专门空间进行自由实验,通常不会造成伤害风险。
FCA 积极主动地为金融科技企业创造受欢迎的环境,使得伦敦成为世界上最重要的金融科技中心之一,其他国家也纷纷效仿FCA 提出的监管沙盒。2020 年9 月,欧盟委员会宣布了一项欧盟范围内的监管区块链技术另一种变体的沙盒[9-10]。截至2020年11 月,全球57 个金融监管机构共设立了73 个监管沙盒[11]。2023 年初,欧盟委员会针对涉及分布式记账技术(distributed ledger technologies,DLT) 的创新应用案例推出欧洲区块链监管沙盒[12]。
沙盒作为一个有限制的、定义明确的空间,在没有造成更广泛的伤害风险的条件下,可有效测试新的和(或)具有风险的技术。FCA 推出监管沙盒的直接目的是适应、支持英国快速发展的金融科技,例如测试区块链技术在记录安全金融交易方面的可行性等。鉴于区块链技术萌芽、发展、过度炒作与实际需求,监管沙盒并非简单地豁免监管,而是通过监管部门高度参与和精心构建,与行业一起做出务实的、基于信息和具体体验的决策,持续解决问题。在某种程度上,监管沙盒这种在真实世界环境中测试新解决方案的模式与计算机科学中的虚拟沙盒类似[13]。
对于监管机构,第一,监管沙盒是平衡金融创新与风险的有效监管手段。一方面,监管机构改进了传统的事前授权批准的监管模式。监管机构向企业颁发有限的授权,在确保安全的前提下,为企业提供创新的机会,同时使得沙盒内的风险可控。另一方面,监管沙盒在测试的同时,融入了监管机构的事前审核、实时监督、动态评估以及对消费者保护的要求,不仅可以让创新产品在较大限度内得到测试,而且可以保证最终进入金融市场的都是真正的创新产品,同时还能有效减少潜在风险的扩散。第二,在监管沙盒中,监管机构可以充分了解企业创新方案的金融本质、内含风险和具体操作手法等,为其进一步制定政策积累经验。监管沙盒让监管机构在创新产品真正面世前就有机会了解潜在风险,提前沟通协调,从而有效降低创新产品面世后的监管成本。第三,监管沙盒可以为监管机构厘清金融创新与金融监管之间的关系提供更清晰的视角和方向。金融科技和混业经营①的发展进一步放大了金融监管权的不对称性、监管规则的滞后性等负面效应,而监管沙盒可以有效控制此类负面影响。在监管沙盒中,监管机构可以通过对测试的监控,及时了解金融科技行业的发展动态,鉴别确认有损消费者权益、不合时宜、亟需修订的监管规则,同时也可以发现已有监管体制在应对创新产品时所存在的漏洞与缺陷,以便及时调整和补充,进一步完善金融监管体系。
对于被监管者,推出监管沙盒,一是有助于以更少的成本加快产品上市时间。来自其他行业的研究表明,监管程序造成的延误,对创新企业产生了非常不利的影响。这种损耗会导致上市时间增加近33%,浪费全生命周期产品收入8%[14]。因此,监管沙盒有利于改善开发机构获得股权融资的机会。二是有助于对创新技术的正常估值。由于监管不确定性,投资者和风险资本机构可能会对金融科技初创企业保持警惕,从而损害这些刚起步的公司在成长阶段筹集急需资金的前景。对其他行业的收入研究表明,监管不确定性可能会导致估值降低15%[14]。三是让消费者真正体验到创新技术带来的实惠。由于很多金融科技初创企业面临的监管挑战,创新产品或服务从未得到测试。FCA 希望引入监管沙盒能为公司提供在测试阶段管理其监管风险的手段,并使消费者能够真正体验到概念产品[15-16]。
监管沙盒的根本在于保护消费者的权益。对于金融消费者,首先,金融创新机构需在沙盒测试前期向消费者告知测试的具体情形及潜在风险,征求消费者的建议、意见,只有在完全得到消费者同意时方能将其纳入测试,充分保障消费者的自由权和知情权。其次,消费者在测试过程中享受与其他客户同等的权利,消费者可随时向参与测试的企业和监管机构投诉,消费者的公平交易权得到充分保障。最后,企业和监管机构要针对客户建立专门的补偿机制,消费者在公司测试失败后可享受一定的金融服务补偿(包括投资损失在内的所有损失),且无需承担任何与测试企业进行交易相关的风险,以保障针对消费者的赔偿和救济权。此外,除了传统意义上对于消费者知情权、自由权、公平交易权、隐私权、安全保障权、救济权以及依法求偿权等这些基本权益的保护,监管沙盒还可通过降低价格、提高服务质量、互惠交易、增强便利性和可获得性等, 多方面扩大消费者受益范围, 进一步丰富保护金融消费者权益的内涵。
2、 监管沙盒的特点
传统的自上而下监管模式通常以保障公共安全为前提,所采用的传统政策制定模式在运用于未成型技术时,并不能充分反映可能面临的监管失灵风险,而这样的风险往往与技术未充分成型的程度成正比[17]。考虑到很多新技术存在不确定性,并结合对风险- 获益的评价,大多持谨慎态度。因此,监管机构的目标是最大程度地利用现有的监管框架来防范潜在危害,或者采取极端的做法,严格遵守对监管机构的授权,保持现状[18]。自上而下的监管模式要求所有变革都必须通过证明技术安全性。申办方需要在按部就班的检测环境中,向立法机构或监管机构提出请求,先制定适用的法律、法规或指南。这样的过程需要耗费大量时间,在一定程度上影响了技术发展速度[19]。
与传统的自上而下监管模式相比,监管沙盒是基于原则的监管,参与沙盒的公司被赋予一定程度的灵活性和自由裁量权,在适应创新的同时,符合沙盒体系列出的目标。这样的做法,并不妨碍公开发布一项技术之前进行试验使用;沙盒的真正目的是允许开发机构在真实条件下部署技术,获取真实世界的用户行为。记录这种行为对于沙盒体系也很重要,监管沙盒要求开发机构将报告数据反馈给监管机构,使得监管机构可以有效地监控技术。对于开发机构,这样的情况存在一些差异,但作为监管沙盒一部分的授权批准,必须经过监管机构,这一点与传统监管需要正式获得监管机构批准后才能用于最终用户,没有太大区别。
与此同时,与正常批准相比,监管沙盒的应用范围可能受限,相关产品只能部署用于特定用途或特定消费者或特定人群。监管沙盒也可能受时间限制,例如限制在固定的持续时间内,或直到某些干预措施结束。监管沙盒的参与者也有严格规定,只限于受信任的参与者,参与者在参与到沙盒中之前,需要获得监管机构批准。
设立监管沙盒的初衷并非取代监管。相反,监管沙盒通过允许开发机构生成有关新技术的真实世界信息来改进监管,而不只限于严格的实验室检测环境,对开发机构、代理机构和消费者都有益。
3、 用于颠覆式创新医药产品的监管沙盒
尽管欧盟GPL(提案)首次寻求以立法的形式建立医药产品监管沙盒,但事实上,医药产品监管沙盒概念早已付诸实践。
3.1 医药产品获批的典型流程
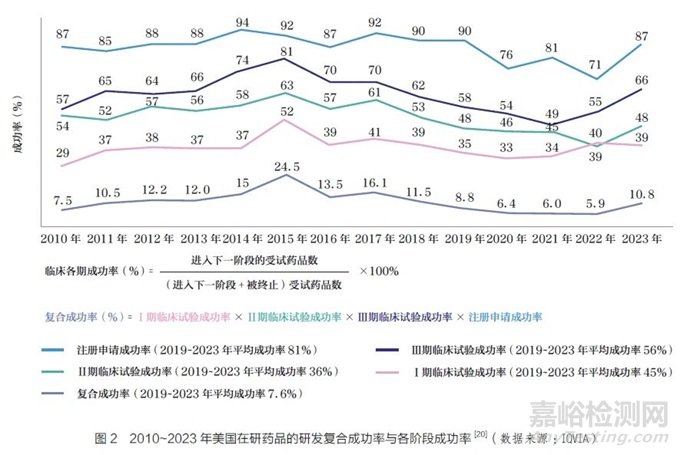
以美国食品药品监督管理局(FDA) 为例,FDA 对药品和医疗器械监管有严格规定,未经FDA 事先批准的药品和医疗器械不得进入州际贸易。FDA 设计医药产品审评体系的初衷是为合理处方、安全用药提供必要保障,即只有安全、有效、质量可控的药品才能进入市场。基于创新药品和(或)医疗器械的新颖性,其获批过程大多时间较长、成本较高、困难较多。对于创新药品和(或)医疗器械,申请人必须证明相关产品安全、有效、质量可控。临床试验是证明安全性、有效性的主要工具,必须在药品监管部门的监督下开展。一旦完成临床试验,在提交申请获得受理后,由相应的产品中心审评,有时会提交给咨询委员会审查。咨询委员会建议监管机构予以批准或不予批准,但咨询委员会只有建议权,是否予以批准的最终决策权在监管机构。整个研发、申报过程,耗时可长达20 年。以新药研发为例,根据IQVIA 统计[20],2019~2023 年之间进入研发管线的在研药品,最终获得FDA 批准的平均复合成功率仅为7.6%,见图2。但即便经过严格的临床前评估与临床试验,由于上市后仍可能出现临床试验中未出现过的不良反应,近年来仍然多次出现获批药品撤市或招致诉讼的情况。
在权衡消费者的选择和产品安全的合理保证方面,针对医疗器械的审批政策通常更为开放。在很多情况下,FDA 在器械生命周期的早期,就在某种程度上接受获益- 风险的不确定性,同时允许患者获得有潜力的重要技术,支持相关技术的迭代、完善[21-22]。但对于风险较高的医疗器械,例如用于心脏瓣膜置换术的医疗器械,仍然需要经过严格的临床试验。
3.2 医药产品紧急使用授权(EUA)具备监管沙盒的典型特征
严格合规的临床试验和正式的审批程序并非药品或医疗器械大规模进入市场的唯一途径。在公共卫生紧急状态下,紧急使用授权(emergency use authorization,EUA)成为FDA快速推出相关药品与医疗器械的得力工具[23-24]。包括EUA 启动、评估、授权和授权终止等多个环节在内的管理机制和科学评价标准为医药产品EUA 提供了有效保障。该过程由卫生部长牵头,涉及包括FDA、国立卫生研究院(NIH)、疾病预防与控制中心(CDC)在内的多个公共卫生机构。
一旦决定并宣布进入公共卫生紧急状态,FDA 就开始审评相关的EUA 请求,如果认定相关请求合适并可行,将进一步与NIH和CDC 交流讨论。以现有的整体科学证据(totality of scientific evidence)(包括来自于充分和严格合规的临床试验的数据)为依据, 有理由认为, 候选EUA产品对诊断、治疗或预防相关疾病或事态,或是对由另外的EUA授权产品或是其他情况下获批或获得许可的产品引起的严重或威胁生命的疾病或病症有效。如果请求被认定为符合法定标准,由FDA 局长签发EUA。EUA 的终止与相关的紧急状态有关,一旦取消紧急状态,将取消相应的EUA。
风险- 获益平衡是FDA 审批新药或医疗器械的基础。但对于EUA,FDA 的关注点是整体科学证据,而不只是来自于严格合规的临床试验的证据,且必须考虑紧急状态造成的实质性威胁。
任何依据EUA 寻求授权的产品,都不能被FDA 批准用于相同的适应症。这种要求也是一种管理约定(administrative comity),即根据EUA 进行授权,会带来一些挑战和例外情况,可能不适用于针对完全批准产品的要求或与针对完全批准产品的要求相冲突。《公众使用意愿与紧急状态准备法案》(Public Readiness and Emergency Preparedness Act)规定了对EUA“提供与授权活动相关的无过错伤害责任豁免”[25]。依据EUA 获得授权的产品,在法律上并不被视为获批。
根据相关法规规定,卫生部长有权依据EUA 的所有附加条件或“可能通过法规规定的其他标准”授权或拒绝产品。此外,卫生部部长可以豁免FDA 实施风险评估和缓解策略(REMS)的要求。
EUA 授权产品的销售商有义务向FDA 持续报告产品在具体部署中的相关信息,包括及时上报有关不良事件的信息,在授权生效期间及之后的合理时间段内采集、分析EUA 产品的安全性和有效性信息等。此外,销售商还必须向医疗保健专业人士和患者告知并不断更新产品授权的性质,包括相关产品获益- 风险的未知程度。申请人和监管机构之间实时共享数据。对于药品生产企业,FDA 必须为生产未批准产品的药品生产企业建立条件,以保持记录并授权FDA 有权获得有关EUA 产品的记录。与典型的审批流程相比,主要在监管机构审批之前需要这类信息,需要的审批之后的这类信息相对较少。
新冠大流行期间,FDA 新冠治疗药品和疫苗EUA 计划成为FDA 历史上前所未有的激进计划。EUA 与典型的FDA 审批流程形成鲜明对比,具备监管沙盒的基本特征。在技术与监管方面,EUA 体现了一定灵活性。总结新冠大流行期间FDA 在EUA 方面的教训与经验,有助于了解监管沙盒以及在监管机构公信力下降、政治干预等多重因素交叉影响下FDA 如何秉持监管标准并实施。FDA 在EUA 方面的经验显示出监管沙盒针对未充分探索和理论化的新技术治理的特征。从监管沙盒的视角分析FDA 在EUA 方面的经验教训,可为药品监管机构更好地应用监管沙盒这一工具积累有益经验[26]。
医药产品EUA 监管模式不同于传统的监管机构命令和被监管者受控模式。EUA 监管模式有可能成为FDA 对新疗法和医疗器械的批准程序的典型代表[27]。在传统的监管模式中,FDA 要求研发机构在向公众提供新治疗技术的相关产品之前需首先证明安全性和有效性,这通常需要数年才能完成,同时研发机构需耗费大量的人力、物力和财力等,尤其是要开展耗资动辄以数亿美元计的临床试验[28]。无论对错与否,这种严格性往往会面临批评,尤其是在面临公共卫生危机时[29-30]。EUA 不等同于批准相关产品上市,同时具有严格的时间限制[31]。在宣布进入突发公共卫生紧急状态后,FDA 根据整体科学证据,快速授予相关医药产品紧急使用授权,同时要求开发机构不断向FDA 报告实验数据[23]。EUA 旨在鼓励开发针对正在遭遇的危机的新技术,在紧急状态下,EUA在一定程度上降低了监管“门槛”,有利于推动创新产品的研发进程,加快创新产品的临床应用。
EUA 聚焦于紧急状态下开发实用的新技术,同时需要符合对试验数据共享的要求。EUA 的构成要素中,也包括了开发机构与FDA 交流沟通时提供的强有力的建议、意见[24,32]。EUA 在技术上具有灵活性[33]。最引人注目的是,获得EUA 的产品,不只限于应用到临床试验场所、实验室等受控环境中,还可部署到真实世界环境中。EUA 与其他FDA 批准程序明显不同,但与监管沙盒类似,即明确规定了应用范围、持续时间、开发机构和相关产品接受者等多方面的限制条件。尤其是新冠大流行期间[34],在公信力下降、政治干预、监管标准变化以及监管对监管速度的影响等交叉重叠影响的背景下,分析并总结FDA的EUA 的监管沙盒特征,对监管科学研究具有重要意义[33]。但FDA 在EUA 方面的经验可能只是一种公共卫生例外论,即FDA对公共卫生的监督在行政法领域具有某种独特性。尤其是面对百年来最大的公共卫生危机的新冠大流行,更是如此[35]。
作为一家公共卫生机构,FDA 预先批准的真正目的是确保不安全或无效的产品无法进入市场[36]。在对创新药品、医疗器械和疫苗等的审评过程中,FDA 重点关注在类似于实验室条件下的体验以证明产品的安全性和有效性,其过程漫长、成本高昂,且大多存在不确定性[37-39]。相比之下,EUA 产品是在风险- 获益基础上获得授权,有时并没有现成的标准可循,同时在很多方面受到限制,更容易被FDA 撤销授权[21]。
EUA 带有与监管沙盒相似的明显特征。FDA 的EUA 计划类似于FCA 的金融科技监管沙盒计划,即并非标准的简化或放弃授权,而是试图通过允许更多的行业进行试验并收集所有结果数据,来有效改善新技术的监管模式[40]。具体体现在以下6 个方面:①实验和数据共享。EUA 依据整体科学证据进行评估,意味着以更为具体的方式持续采集数据并进行审查,例如FDA 对EUA 授权条件中的信息采集的关注,开发机构需公布检测方案,以此推动数据透明。对数据透明度的要求,使得新数据在进入FDA 时,开发机构和FDA 能够评估、修订授权产品。如果可获得的科学证据发生了变化,或者出现了新的信息,FDA 可以对EUA 进行调整,包括修订使用授权或撤销EUA。②开发机构输入(input)。对于新冠大流行期间授予EUA 的疫苗产品,在整个EUA 申请过程中,FDA 和开发机构之间进行了大量交流讨论,开发评价拟采用疫苗的获益是否超过相关风险所需的科学证据、如何向FDA 持续报告此类信息以及技术可行性等的方法。对于疫苗之外的其他产品,在申请过程中和授权后,修订EUA 对信息共享和开发指导要求。因此,结合EUA 具有的务实、以信息和体验为基础、持续解决问题、高度参与、精心组织对话等特点[41],可在一定程度上将EUA 理解为医药领域的监管沙盒。③技术灵活性。与其他领域的监管沙盒一样,EUA 足够灵活,可以应用于更广泛技术的不同迭代[39]。尽管每个EUA 都具体针对特定产品,但有些EUA 允许不同开发机构之间存在差异。这种情况多见于体外诊断领域,例如FDA 推出的伞式EUA,允许开发机构使用似乎适用组件的参考清单,用于构建自己的授权产品;同时在检测方面,FDA 允许以桥接研究的形式提供诊断检测,即将有效性与已经授权的检测进行比较的检测[42]。这使得EUA 转变为更广泛的基于原理的监管模式。改变已批准的产品的核心技术通常需要FDA 的预先批准,这与具有内置实验灵活性的EUA 形成鲜明对比。④在真实世界环境中检测。在监管沙盒实验中,企业可在真实世界环境中检测创新产品、服务、商业模式和交付机制,同时一旦出现问题不会立即承担所有正常监管参与相关活动的后果。EUA 也允许开发机构做到在市场上销售相关产品, 即在真实世界条件下检测[24]。⑤对范围、期限、身份和参与者加以限制。与其他领域的监管沙盒类似,EUA 会通过各种方式对范围、期限、身份、开发机构等加以限制。EUA 的授权方式与药品的正式批准方式最显著的相同之处在于均针对具体适应症[24]。不同的是,EUA 产品大多针对特定用途(由开发机构与FDA 协商确定),且范围限制更严,医生不能通过标签外处方获得EUA 产品[23]。EUA 授权也有时间限制,EUA 产品仅适用于紧急状态期间,或者依据相关法规,可使用至出现获批的替代产品或获得EUA 授权产品本身得到FDA 的正式批准为止。与正常过程中批准的产品的限制相比,对EUA 所涉及产品的限制,具有不同的特征。尽管获得EUA 的产品可能会在适应症方面受限,但在紧急状态下,往往适用范围较广。除非FDA 另有说明,完全批准的产品基本上没有期限限制。对于获得EUA 的医药产品,为满足应急响应要求,在一定条件下,允许FDA 豁免在其他情况下适用的现行药品生产质量规范(cGMP)要求(例如贮存或处理);但对于完全批准的产品,并没有这样的豁免。⑥加快创新产品开发。从理论上讲,与传统的监管模式相比,监管沙盒通过允许实验,有助于加速创新,更快地将更安全、更有效、甚至是更经济划算的产品推向市场。监管沙盒(即使是有限的和临时的)创造了一个新进入者可以竞争、新的创新可以蓬勃发展、能够测试和改进新产品的环境。监管沙盒通过更大的多样性和更快速的选择加速了开发与迭代过程。公共卫生紧急状态下,对医药产品创新的重要性与速度要求更为迫切,成功的EUA 为亟需的颠覆性创新医药产品开发提供了灵活性更高的平台。
3.3 欧盟医药立法:监管沙盒为创新者成长提供安全空间
作为促进创新政策目标的一部分,欧盟委员会公布的GPL(提案)中提出了医药产品监管沙盒的概念。在通过立法程序后,医药产品监管沙盒将成为一个结构化、受监管和具有时限限制的环境,在此环境中,创新技术、产品、服务或方法可在真实世界环境中测试,并受到适当的保护[1-2]。
目前很难预测哪些技术可以从监管沙盒中获益,但根据相关定义,这些技术有望在立法通过后被视为创新技术。该提案设想沙盒将用于评估服务和方法,并特别提到在数字化背景下的部署,显然针对数字医疗和人工智能做出了设定。
预期监管沙盒不仅能促进创新,还能为相关政策制定机构、立法机构和监管机构提供机会,使其能依靠沙盒中产生的实际证据,在医药产品开发的早期阶段做出响应,而不是在创新产品接近市场时才试图做出响应。从监管沙盒中获取的数据和信息可为今后欧盟药品规则的修订提供参考,也可能对上市批准通道带来适应性更强或更具灵活性的方法。
GPL( 提案) 第Ⅸ 章第113~115 节规定了建立医药产品监管沙盒的程序,并设想欧盟委员会将通过立法提供更多细节,包括医药产品监管沙盒的资质和选择、参与者的权利和义务等。
EMA 将对新兴医药产品和相关技术的发展进行监控,并可能在此背景下与上市许可持有人、开发机构、独立专家和研究者、临床医生和患者接触,要求他们提供信息和数据。
只有在以下情况下才有可能设立医药产品监管沙盒:①与产品相关的特性或方法,可能会对产品的质量、安全性或疗效做出积极而独特的贡献,或在患者使用方面提供巨大优势,因此不可能按照现行法规开发药品或产品类别。②医药产品监管沙盒只适用于早期开发阶段的创新产品。但如果授权产品的早期开发符合前述标准,也可以采用沙盒。③如果EMA 认为某个医药创新产品适合进行监管沙盒实验,可建议欧盟委员会设立相关监管沙盒计划。该建议必须列出监管沙盒的细节,包括所涵盖的产品,监管沙盒的临床、科学和监管依据(包括无法遵守现行监管要求的说明,以及相应的替代或缓解措施),以及沙盒持续时间。在适用情况下,EMA 还应进一步寻求减轻因设立监管沙盒而可能造成的“市场扭曲”的办法。
根据该条例的设想,欧盟委员会随后将通过一项具有法律约束力的决定,在一定期限内设立医药产品监管沙盒。如果设立监管沙盒的条件不再适用,或出于保护公众健康的目的,欧盟委员会也可以中止或撤销监管沙盒。如果随后发现监管沙盒对公众健康构成风险,但通过采取补充条件可以缓解这种风险,欧盟委员会可在与EMA 协商后,通过实施法案的方式修改其决定。同样,监管沙盒的期限也可通过实施法案予以延长。
医药创新产品在监管沙盒中的使用将受到严格限制,即在获得上市批准之前,不得正式投放市场。
但沙盒的建立将对一些监管程序产生影响:①国家临床试验监管机构在批准临床试验时必须考虑沙盒计划。②如果产品在获得上市许可时仍处于沙盒中,则上市许可的初始有效期将受限于沙盒的持续时间,但可应上市许可持有人的要求予以延长。③在适用情况下,上市许可必须考虑到沙盒计划中的缓解措施。④沙盒计划和上市许可均可包含对欧盟药品法律要求的减损,但仅限于为实现所追求的目标而严格必要的适当减损,并在上市许可的条件中适当说明和具体说明;一旦获得批准,相关产品的产品特征概要和包装说明书必须说明该药品是作为监管沙盒的一部分开发的。
国家监管机构将对监管沙盒中的产品行使监督权和执法权。国家监管机构可以限制相关产品使用或暂停沙盒中的研究,直到适当的缓解措施到位。参与监管沙盒实验的创新产品也不会影响欧盟法律规定的产品伤害责任。
监管沙盒的灵活性被认为与数字化、人工智能和机器学习密切相关[43-44]。传统的监管模式往往无法适应由创新数字技术驱动的药物发现、开发或管理方面的创新。因此,提供此类产品和服务的企业可能会面临监管限制,从而阻碍其进一步发展。
医药产品监管沙盒目前尚处于初步探索阶段,很多细节和资质尚待明确,但其在依赖真实世界证据、加快创新产品的市场准入速度等方面潜力巨大,未来可能会有各种各样的创新产品从监管沙盒中获益。
3.4 人工智能气闸(AI Airlock)监管沙盒
2023 年10 月,英国药品和健康产品管理局(MHRA)宣布将创建AI Airlock 计划[45]。2024年4 月,MHRA 宣布在AI 政策文件中纳入上述沙盒。MHRA 计划在试点项目中纳入4~6 个虚拟或真实世界项目,以测试医疗服务中相关设备用于临床目的时的一系列监管问题。2024 年5 月,MHRA 宣布推出人工智能气闸(AI Airlock)监管沙盒,旨在帮助了解与作为医疗设备AI(AIaMD)相关的风险[46]。AI Airlock 监管沙盒的目标是确定作为AIaMD 在监管方面可能面临的困难与挑战,并通过协作来了解、降低已发现和(或)认定的所有风险。利益攸关方和产品提供商将根据AIAirlock产品报告共享数据和信息,以协助进一步的资助或评价活动。
AI Airlock 监管沙盒的目标并非保证符合监管要求,但参与到这一计划中的制造商可能在监管过程中受益。AI Airlock 监管沙盒可帮助检测和报告产品性能差错(包括上市后监测数据中的漂移和失效模式),还可提供上市前的安全性证据,以及破解基于生成式AI 的医疗设备的复杂性等。
MHRA 希望将试点重点放在能够涵盖一系列监管问题、临床学科和监管成熟度的少数几种产品上。每个产品的AI Airlock 监管沙盒都将根据创新的具体需求进行设置和定制,以灵活应对潜在问题,并在可接受的风险水平内最大限度地利用机会来探讨关注点。AI Airlock 监管沙盒的成功申请者必须以透明方式与项目团队合作,之后各方将从各自的角度撰写报告,总结所取得的成就和经验教训,为监管政策和指南的制定提供依据。
MHRA 将与合作伙伴合作开展试点工作, 其中包括英国医疗器械认证机构协会(the UK Association for Medical Device Approved Bodies, 简称为Team AB)和英国国民医疗服务系统(NHS)[47]。Team AB 的参与可以使英国医疗器械监管要求的解释更加一致,而很多AIaMD 产品最终将用于NHS。
4、 结语
监管沙盒是一种对时间、范围、期限等予以限制的新的监管模式, 允许在监管机构的监督下在真实世界环境中进行测试,以促进创新产品的开发和授权。监管沙盒的法律基础是所谓的“试验条款”,即允许在一定程度上豁免现行要求, 尝试新的监管解决方案。监管沙盒不仅能为企业创新提供重要机会,还有利于监管机构在创新产品的早期发展阶段获得相关信息,从而发现、探索并确定监管相关的颠覆式创新的最佳方法。从监管沙盒中汲取的经验教训,可为今后的医药产品监管改革奠定基础, 有助于监管者以积极主动的方式应对创新, 跟上科技发展的步伐。
现行药品监管体系依据相关法律法规授权监管,大多以行政机构为主导。但随着颠覆式创新技术的出现和迅速迭代,立法、监管“授权”可能相对滞后,且往往缺乏明确的监管边界,很少有现成可用的监管范式。监管沙盒提供了一个安全空间,寻求将创新产品投入市场的企业可以在其中测试创新产品、服务、商业模式和交付机制,而一旦出现问题不会立即承担参与相关活动的所有正常监管后果。这主要集中在几个要素上,即监管机构对实验数据的采集、基于行业输入的结构、更广泛技术不同迭代的灵活性,以及在真实世界条件下的测试。EUA 具备了监管沙盒的特征,与FDA 的正式批准流程不同,EUA 允许FDA 在紧急状态下使用整体科学证据标准授权,并在需要的情况下迅速撤回新产品。作为一种务实、基于对话和原则的新的监管模式,在很大程度上可以将新冠大流行期间的EUA 视为一种监管沙盒,其对时间和范围的限制旨在改进而不是取代典型的监管途径。
近十年来,监管沙盒主要被监管机构用于推动一系列领域的创新。特别是在金融科技领域,监管沙盒产生了重要影响。在医药产品监管领域,欧盟率先寻求以立法形式引入监管沙盒。运用监管沙盒工具可使监管机构在开发早期就介入,并通过与开发机构、利益攸关方协作,丰富监管工具,有助于解决传统监管模式下难以应对的颠覆式创新医药产品开发难题,加快相关产品开发。
①混业经营系指商业银行及其他金融企业,以科学的组织方式在货币和资本市场开展多业务、多品种、多方式的交叉经营和服务。
引用本文
吴婧,吴天贺,姚立新*.用于颠覆式创新的医药产品监管沙盒浅析[J].中国食品药品监管.2024.08(247):78-89.

来源:中国食品药品监管杂志


