您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-09-29 15:14
FDA发布多类器械基于安全性和性能的路径特定设备指南
当地时间9月27日,FDA发布基于安全性和性能的路径特定设备指南,分别是《气动牙科手机和气动马达-基于安全和性能的途径的性能标准》、《牙科水门汀-基于安全和性能的途径的性能标准》、《牙科陶瓷-基于安全和性能的途径的性能标准》、《牙科印模材料-基于安全和性能的途径的性能标准》。
FD&C法案并未禁止FDA使用性能标准来促进这种比较。如果等同器械在安全性和有效性方面达到一定水平,而新器械在相同特性方面也达到这些性能水平,FDA可能会认为新器械与等同器械一样安全有效。
FDA无需审查两种器械直接对比测试的数据,而是可以通过数据证明新器械达到相应先验设备的性能水平,从而支持实质等同的结论。
今天为大家分享气动牙科手机和气动马达和齿科水门汀的指南内容,供大家参考。
气动牙科手机和气动马达指南
本指南为气动或直角和直角连接的牙科手机和气动马达提供了性能标准,以支持基于安全和性能的途径。在此框架下,计划使用基于安全和性能的途径提交510(k)的提交者可以选择使用本指南中提出的性能标准来支持实质等同,而不是将计划申请510K的器械的性能与等同器械的性能进行直接比较。
2019年9月,FDA发布了一份指南,为某些易于理解的器械类型描述了一种可选途径-基于安全和性能的途径,提交者可以证明新器械符合FDA规定的性能标准,从而证明该器械和已在FDA获得认证的器械一样安全有效。
为了确定一套特定的性能标准,以满足提交者对特定器械类型的适当先验的比较,FDA已确定性能标准应代表该设备类型中一种或多种已在FDA获得认证的器械的性能。利用本指南中确定的性能标准,可选的特定设备安全和性能路径能够提供一种符合公共卫生要求的、负担更轻的政策。
一.范围/器械描述
本指南所涉及的器械是牙科气动手机和气动马达(CODE是EFB)或弯角和直角附件(CODE是EGS)。这些属于21 CFR 872.4200规定的I类(保留)设备。本指南的范围包括主体由金属(例如不锈钢或钛)制成、最高转速为每分钟450,000转(RPM)且最终用户需进行灭菌的器械。
本指南所涉及的牙科手机适用于普通牙科,包括以下功能:切割和打磨牙齿;龋齿制备;牙齿和牙冠制备;牙齿和填充材料的修整和修剪。
二.预期用途/使用说明
本指南所涉及的牙科手机是指用于普通牙科的气动牙科手机和气动马达。这些器械属于处方设备。
具有以下预期用途或特征的牙科手机不在本指南范围之内:

三.器械设计特点
新产品为处方用气动牙科手机和气动马达,由训练有素的牙科专业人员使用,用于去除龋坏物质、龋洞、牙冠准备,以及作为手术工具用于去除撞击的第三磨牙和牙周手术。
气动牙科手机和马达使用压缩空气作为动力源,驱动手机头部的涡轮,使牙科手术中的钻头旋转。手机的头部设计有一个分块装置,用于插入牙科锉/柄,锉体可为直形或斜形。手机的底座上有孔,通过与气动马达或软管连接,驱动空气、喷射空气和/或喷水通过这些孔。
气动马达可由外壳、手机接口和用于软管连接(即供气和供水)的接头组成。气动马达将压缩空气转化为机械旋转能量。压缩空气进入气动马达,通过联轴器将能量传递到与马达相连的直手机或弯手机上。
四.测试性能标准
如果适合通过 “基于安全和性能的途径 ”递交,并且申报方选择使用该选项,FDA不希望申报方提供与等同器械的直接对比测试,以证明实质上等同的性能特征。
为确保本指南中概述的性能标准与时俱进,并考虑到最近批准的相关数据,FDA 建议除了提供以下建议的其他提交信息(如符合性声明 (DOC) )外,还提供以下每项测试或评估的所有评估测试的结果摘要。
根据 FDA 对所有 510(k)申请的政策,FDA 可在必要时要求和审查证明新器械符合 FDA 确定的性能标准和测试方法的基础数据。除非在以下章节中另有说明,否则测试信息(如结果摘要、测试协议或完整的测试报告)应作为 510(k) 的一部分提交,如 FDA 的指南《基于安全和性能的途径》中所述。
有关提交non-clinical bench testing测试信息的更多信息,请参阅 FDA 相关指南。有关 DOC 应包括的补充文件的信息,请参阅 FDA 自愿共识标准指南。
五.Mechanical Bench Testing
FDA建议为本部分的测试提供一份测试报告单和一份 ISO 14457 DOC。
1.测试名称:I-Drop test
2.测试名称:Noise Level
3.测试名称:Surfaces
4.试验名称:Air-powered handpieces and motors
5.试验名称:Water Supply(如适用)
6.测试名称:Handpiece cooling air provided by the motor(如适用)
7.测试名称:Spray air supply(如适用)
8.试验名称:气压和水压
9.试验名称:漏水和/或进水
10.测试名称:操作控制
11.测试名称:可用性
12.测试名称:Connect and supply
13.测试名称:连接高速气动涡轮手机和气动马达连接器
14.测试名称:手机和马达的连接
15.测试名称:Metallic chuck system
16.测试名称:Test mandrel
17.测试名称:速度
18.测试名称:Eccentricity
19.测试名称:Stall torque(如适用)
20.测试名称:Dimensions of the head and nose
21.测试名称:高速空气涡轮手机的输出功率(如适用)
22.测试名称:带照明的手机(如适用)
23.测试名称:Resistance to Reprocessing
24.测试名称:Reprocessing(最终用户清洁和消毒)
生物兼容性评估
使用 ISO 10993-1,Biological evaluation of medical devices – Part 1: Evaluation and testing within a risk management process,FDA 认为本指南涵盖的器械属于与粘膜接触的表面器械,接触时间少于 24 小时,应根据 FDA 生物兼容性评估以下终点。
-细胞毒性
-致敏性
-口腔粘膜刺激
26.试验名称:Biocompatibility endpoints
方法:FDA认可的生物相容性共识标准版本:
·ISO 10993-1 Biological evaluation of medical devices – Part 1: Evaluation and testing within a risk management process
·ISO 7405 Dentistry – Evaluation of biocompatibility of medical devices used in dentistry (this standard is an application of ISO 10993-1 to dental devices)
牙科水门汀指南
一.范围/器械描述
本指南的范围包括牙科水门汀,这些牙科水门汀下列法规和产品代码中的 II 类器械。
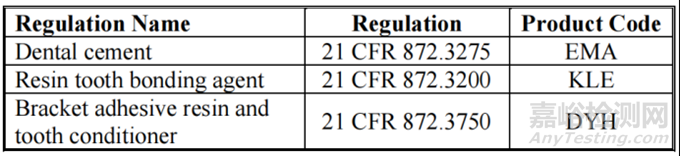
下列产品不属于本指南的范围:

二.预期用途/使用说明
属于本指南范围内的修复装置是牙科水门汀,用于临时补牙或作为粘接临时补牙的基底水门汀,粘接牙冠、牙桥或正畸托槽等牙科器械,或涂抹在牙齿上以保护牙髓并提高修复体的固位。这些器械仅供处方使用。
三.设备设计特点
本指南中的性能标准适用于 FDA 认可的共识标准
ISO 9917-1 Dentistry – Water-based cements – Part 1: Powder/liquid acid-base cements 和ISO 9917-2 Dentistry – Water-based cements Part 2:Resin-modified cements.
ISO 9917-1 Dentistry – Water-based cements – Part 1: Powder/liquid acid-base cements适用于机械搅拌的手拌水门汀和胶囊水门汀,其中牙科水门汀根据其化学成分分类如下:
-磷酸锌水门汀
-聚羧酸锌水门汀
-聚羧酸锌水门汀
ISO 9917-2 Dentistry – Water-based cements Part 2: Resin-modified cements 根据其固化特性将所用材料分类如下:
-第 1 类材料:成分混合后,可聚合成分的固化反应通过化学方式激活的材料。
-第 2 类材料:可聚合成分的固化反应是由光激活的材料。
-第 3 类材料:可聚合组份的固化反应是在组份混合后以化学方式激活的,也可 以是光激活的材料。
四.测试性能标准
1.测试名称:Adhesive bond Strength
2.测试名称:Ion release profile (如适用)
3.测试名称;Film Thickness(如适用,仅限于luting cements)
4.测试名称:Net Setting Time (tsetting)
5.测试名称;抗压强度(如适用,仅限powder/liquid acid-base cements)
6.测试名称:酸腐蚀(如适用,仅适用于粉状/液状酸碱水泥)
7.测试名称:工作时间(仅适用resinmodified cements)
8.测试名称:Flexural Strength(仅适用resinmodified cements)
9.测试名称:吸水性
10.测试名称:水溶性
生物相容性评估
要确定生物兼容性终点,作为生物兼容性评估的一部分,应使用 ISO 10993-1 为FDA 认为本指南涵盖的器械属于与组织/骨质/牙本质接触的External Communicating Devices,接触时间较长或永久性的,应根据 FDA 生物兼容性指南评估以下终点:
- 细胞毒性
- 致敏性
- 口腔粘膜刺激
- 急性全身毒性--口服应用
- 亚急性/亚慢性毒性--口服应用
- 遗传毒性
11.试验名称:生物相容性终点(根据FDA生物相容性指南确定)
方法:
· ISO 10993-1 Biological evaluation of medical devices – Part 1: Evaluation and
testing within a risk management process
· ISO 7405 Dentistry – Evaluation of biocompatibility of medical devices used in
dentistry (this standard is an application of ISO 10993-1 to dental devices)

来源:北京倍力医疗技术服务有


