您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-10 08:23
引言
此领域专家可以忽略此文,但据我了解,周围做药的人或新药或仿制药,绝大多数对多晶型还是一知半解或者概念比较模糊,实际工作中,对此关注度并不高,觉得测测差不多就好。然而,其在药物制剂研发、注册申报工作中的重要性不是一言两语就总结清楚的,搞不好,前面的无数个呕心沥血就前功尽弃了,所以在当前的药圈还是有必要科普一下。
多晶型&晶癖
在自然界,一种元素或化合物在不同条件下生成结构、形态、物性完全不同的晶体的现象称为多晶型现象。McCrone在1965年提出的多晶型概念,强调了同一种分子在不同固态晶格中的不同填充、排列方式。近年来,其含义又扩大到互变异构多晶型、构象多晶型以及手性系统等。另外,关于蛋白质、核酸等生物大分子多晶现象的研究也日趋深入。本文着重讨论有机药物领域中出现的多晶型。
有机药物的结晶基本上都属于分子晶格。如利福平分子中有-OH,-C=O,-NH等基团,可在利福平分子间、分子内、分子与溶媒间形成氢键,随着工艺条件的不同而产生不同的晶型。具有一种化学结构的药物,常常可能存在多种晶体形态,也有人为创造不同的结晶条件下获得不同的晶型,多数化学药物存在多晶型现象。造成多晶型现象的原因主要包括药物分子(原子、离子)的堆积与排列的方式不同、溶剂或结晶水的介入以及药物分子的构象差异等。此文多晶型(polymorphs)概念包括晶体状态、无定形态、溶剂化物和水合物。
晶体状态时,由于分子在晶格中具有不同的排列和构象。
无定形态,顾名思义,分子的排列没有规则,不具有可识别的晶格。
溶剂化物,是指晶格中含有当量或非当量的溶剂。如果该溶剂是水,则此溶剂化物通常被称为水合物。
何为晶癖?晶癖是生长着的结晶因结晶条件(溶媒、杂质等)的影响,使分子不能均匀地达到各结晶面,从而产生不同的外形,同一晶系的结晶,外观可呈现不同的形状(晶态),而多晶型则是由于结晶内部构造的分子排列不同而产生,二者有本质的区别。另外,尽管溶媒化物与多晶型物也有区别,但同一药物的不同溶媒化物,也可表现出不同的熔点、溶解度,从而影响药物的生物利用度。对于多晶型物的分析鉴定方法(PLM、DSC、TGA、PXRD、IR法等)同样适用于溶媒化物的研究。
多晶型要不要研究,蜻蜓点水,还是一探究竟
一般而言,药物是以结晶形式或无定形物存在。对于多晶型药物,同晶型的同一药物在在外观、溶解度、熔点、密度、引湿性、制成药物制剂在体内生理环境下的溶出速率不尽相同、生物有效性等方面往往会有显著差异,从而影响药物的稳定性、生物利用度及疗效。
一种原料药可能存在很多的晶型,但有些结构可能是罕见的,并不太可能形成(重现)。例如对于一个已经批准的药物制剂,其原料药可能存在20种多晶型,但实际上只有一小部分多晶型能够在原料药和制剂的生产条件下生成。所以建议申请者仅考虑在原料药生产、药物制剂生产过程中或者在原料药和制剂贮藏过程中可能会形成的多晶型。尤其是实际研发、生产过程中,当原料药存在多晶型时,如何评价其同一性?对原料药和制剂中的多晶型如何监测和控制?
医药研发领域,多晶型现象势必影响新药的生物利用度或仿制药一致性评价中的生物等效。这种现象在口服固体制方面表现得尤为明显。尼莫地平不同晶型疗效完全不同,20世纪90年代,我国曾发现进口尼莫地平口服制剂的临床疗效是国产仿制药品的3倍以上,但尼莫地平的纯度、手性方面却几乎没有差别,后来发现是由于两者采用了不同的晶型。
药物多晶型现象的研究已经成为日常控制药品生产、仿制药一致性评价及新药剂型确定前设计所不可缺少的重要组成部分。了解药物的多晶型现象及其性质,将有助于解决下列问题:
保证在制备和贮存过程中药物的物理、化学稳定性;
提高新药生物利用度,减少毒性,增进治疗效果;
保证生产药物每批的等效性;
改善药物粉末的压片性能;
防止药物在制备或贮存中产生不良晶型而影响质量;
提高仿制药一致性评价中生物等效的概率。
如果前期研究不到位,有可能让你历时几年的研究推倒重来,或者增加返工的巨额成本。
药用固体与药用溶液的表征存在很大的区别,其根本原因是药用固体是非均相的。药用溶液为均相体系,大部分可采用HPLC、NMR、GC以及pH测定来表征。而在固体非均相体系状态下,药物系统所含颗粒的粒径和成分不一。同时,固体还具有一些特殊性质,如晶型、药物与辅料相互作用,并且在形成溶液时固体会因溶解而消失。此外,各种固体分析技术所获得得信息量要比相应的溶液分析技术少。因此,研究固体药物时,往往需要联合使用多种分析技术。
结晶固体与药物开发密切相关。在不同类型的制剂中,API大部分为母体化合物及其盐的多晶型或水合物,且大都以结晶态存在。有机溶剂的溶剂化合物通常不作为API,但有助于药物开发过程中加深对API固体性质的了解。一般而言,药物开发以采用结晶态API为佳,但在生产过程中,如研磨、湿法制粒、干燥及压缩,会不可避免地产生不同程度的无定形态。此外,许多药用辅料包括天然聚合物如纤维素和淀粉,以及其他一些经过化学修饰的天然或人工合成的聚合物都是无定形或部分无定形的。同时,几乎每一种结晶态API都会存在少量的无定形态。API本身的无定形成分或其他组分的无定形成分会对药物的理化性质及最终疗效产生复杂的影响。
由于固体内部结构的不同(组成、尺度、形状、对称性、容量/分子数目、单位晶胞的空腔体积以及无定形态缺乏周期性),因此不同的固体会表现出不同的性质。不同的晶型具有不同的性质,如熔点和光谱性质,这些性质可以采用不同的方法检测。其中一些性质对药物开发至关重要,对产品的功效和质量有重要的影响。
不同晶型溶解度为何不同
溶解度:不同晶型的溶解度与其自由能直接相关。因此,即使在相同的溶剂中,不同的晶型亦具有不同的溶解度,并与温度相关。在任意温度(除Tt外)下,亚稳定型比稳定型的溶解度大。溶解度的差异会导致溶出速率的差异,从而引起溶液介导的多晶型转变。一项针对多晶型对之间溶解度差异的调查(n=81)显示,不同多晶型溶解度的比值一般小于2,偶有大于2的现象。假设服从亨利定律,根据热力学规律,不同多晶型溶解度的比值与溶剂的性质无关。在大部分稀溶液中,这个结论是成立的。
另一方面,加合物(溶剂化物、水合物)则显示出不同的溶解行为。溶解度的比值,甚至溶解度的高低次序,在活度不同的溶剂中会发生变化。与多晶型类似,这种现象也是由热力学过程引起的。纯的有机溶剂中,溶剂的活度接近1,该溶剂的溶剂化合物稳定性最高,而溶解度最低。其他固相,如多晶型、水合物、无定形相及其他有机溶剂的溶剂化合物稳定性较低,而溶解度较高。水合物作为一种特殊的溶剂化合物,具有相同的特点。在上述溶解度调查中,无水/水合物(n=24)的溶解度比值较多晶型的溶解度比值范围更广且更高。
热力学分析显示,在低于熔点的任一温度下,无定形态的自由能较相应结晶态的自由能更高。因此,温度在熔点以下时,在任何溶剂中无定形固体比结晶固体的溶解度高。这对难溶性药物给药和提高口服生物利用度具有重要意义。
什么情况下,API成药以无定型为佳
溶出速率和生物利用度:如前所述,如果固体的溶出仅由扩散决定,溶解度和溶出速率间的关系符合 Noyes- Whitney方程。因此,不同固体间溶解度的差异直接导致固有溶出速率的差异。当颗粒的粒径及粒径分布相似时,溶解度的差异也会导致溶出速率的差异,如琥珀磺胺噻唑和碘番酸Ce,一般认为口服吸收主要由制剂在胃肠道中的溶出速率和药物分子透过胃肠道膜的速率决定。
生物药剂学分类中属于Ⅱ、Ⅳ类的药物,溶解度低是其吸收的主要障碍,而利用无定形态则能改善其吸收。因此,对于目前大多数ADME性质较差的候选药物而言,制备成亚稳定型固体(如无定形态和无定形固体分散体),可以作为改善这类药物的工具。选择合适的固体形式对开发高质量的药品至关重要。
值得注意的是,这种方法中溶解度和溶出速率的提高只是一个短暂的效应。在体内外溶出介质中,浓度超过平衡溶解度时会产生一个促进稳定相成核和结晶的驱动力,并最终导致晶核和结晶的形成,药物溶解度降低。但是,这个过程需要一定时间,在这个时间差内药物可发生显著的吸收。对于那些渗透性极高的化合物,可以有效地透过胃肠道膜并被血液循环带走,而不会在胃肠道中发生浓度堆积现象。
多晶型表征高大上吗?
目前有很多方法用来表征原料药的多晶型。通过单晶X-射线衍射确证等同结构被认为是目前权威性确认多晶型的证据,粉末X射线衍射也可为多晶型的确证提供确凿的证据。其他方法:显微镜法、热分析法(差示扫描量热DSC、热重分析TGA和热载台显微镜法)、光谱法(红外IR、拉曼Raman、固态核磁共振SSNMR)可以帮助进一步确证多晶型的特征。
尽管不同晶型的药物其固态理化性质有绝对的差异,但由于仪器分辨率的限制,这些差异常常出现在分析范围的边缘,因此同时采用多种方法进行多晶型研究对于保证分析结果的可靠性具有重要意义。简要概述几种常用的方法如下:
热载台显微镜法: 将待测组分的机械混合物放在载玻片上,盖上盖玻片后用硅油密封,以免样品升华。将玻片置于偏光显微镜的加热台上进行加热,直至完全熔化,待冷却固化后,再恒速升温(如4℃/min),显微观测融点与熔点。此法仅需少量样品便可进行相变点的测定,熔融态物或单个阶段的过冷趋势的评估,稳定和不稳定多晶型的产生及其光学性质的记录。热载台显微镜主观性较强,对实验者的操作经验要求高,不易准确观测各向同性晶体的熔化,只适用于对热稳定的化合物。近年来,摄像技术也被应用到热显微镜法中,可以较为准确地观测到样品的熔融点,以及不同晶体热熔行为的差异。另外,将DSC与热载台显微镜法联用也是近年发展的新型分析方法。
红外分光光度法: 本法的原理是基于同一物质的不同晶型其红外光谱必然会有差异,如旧峰消失,新峰生成,峰位、峰形的变化等,这些谱带特征的差异可源自不同晶型的存在。红外光谱法较为简便、快速,然而图谱的差异也可能来自其它方面的原因,如同系物的错标,样品纯度不够,晶体的大小,晶癖的影响,对粉碎作用的不稳定性以及盐的生成或部分分解等,都可能导致分析结果的偏差。
现在较常用的红外样品分析方法有石蜡糊法、KBr压片法、漫反射法以及衰减全反射法(attenuated totalreflection,ATR)等。因为样品研磨过程中产生的热量更易为液状的石蜡油所分散,而且固体KBr压片过程中,压力本身就可能导致晶型的转变。相比而言,漫反射光谱法在多数情况下可以最低限度地减少晶型转变,适用于样品的预分析。近年来,红外与热显微镜的联用也取得了进展。通过直接对单个小晶体的显微观测,可以减少多晶型转变的可能,实现对微量样品的检测。
X-射线衍射法: 当X-射线以θ入射角照射晶体的平面点阵时,若两相邻点阵间距为d,则两平面光程差为2dsinθ,凡符合Bragg公式,即2dsinθ=nλ的情况下,就发生衍射。分子在晶格中的排列方式不同,从而产生不同的X-射线衍射图谱。具有不同晶格参数的多晶型物,可相应得到不同的X-射线衍射图。
粉末衍射的样品制备方便,较为常用。单晶衍射虽然从理论上讲,可获得较多的有用数据,便于测定晶胞的大小和形状,进而确定结晶构型和分子排列,然而由于较难得到足够大小和纯度的单晶,因此在实际操作中仍有一定困难。近年来发展的小分子衍射区域检测器为分析较小晶体或纯度不够的晶体样品提供了可能。许多样品在使用热分析法、显微镜检查法或红外光谱法无法分辨出差别的情况下,用X-射线衍射方法却能得到满意的结果。
热分析法: 现在最为广泛使用的热分析法包括热重分析法(TGA)、差热分析法(DTA)以及差示扫描量热法(DSC)。TGA是测量样品在加热条件下质量的变化,适用于检查晶体中包含溶剂的量或样品升华、分解的过程。DTA和DSC较为相似,二者都是将样品与一种惰性参比物同置于加热器的两个不同位置上,按一定程序恒速加热(或冷却)。所不同的是,DTA是同步测量样品与参比物的温差,而DSC则是测量输入给样品和参比物的功率差,即热量差,较之测量温差更精确,因此DSC比DTA法更为优越。不同晶型,升温(或冷却)过程中的吸、放热峰也会有差异,从而可根据曲线、熔点峰的不同来确定不同的晶型。热分析法的应用也有助于提高化合物熔点测定的准确性。此法所需样品量少,方法简便灵敏,重现性好,是药物多晶型研究中极为常用的一种手段。
多晶型对药物理化稳定性的影响
药物多晶型在稳定性方面,可分为稳定型、亚稳型和不稳型。稳定型熵值小、熔点高、化学稳定性最好,但溶出速率、溶解度却最小,因此生物利用度也差。不稳型则相反。亚稳型介于稳定型和不稳型之间,但贮存过久会向稳定型转变。如利福平就存在多晶型问题,除影响疗效外,主要影响稳定性。
1976年以前的国产利福平都是无定形,稳定性差,分子内部容易发生氧化、水解及转化,故无法保证有效期。1977年改变工艺条件后,得到亚稳晶型产品,质量显著提高。多晶型药物间可通过溶剂为媒介进行相转变。例如,生物利用度好的磺胺-5-甲氧嘧啶多晶型物Ⅱ,在混悬液中可转变成生物利用度差的水中稳定型,这样不仅破坏了混悬液的剂型稳定性,同时也降低了药效。
多晶型对稳定性的影响还表现在药物的吸湿性。如粟田等报道,β-受体阻断剂醋丁酰心安(Acebutolol)有三种晶型。其中Ⅲ型较Ⅰ、Ⅱ型易受湿度和温度影响,吸湿后经过溶解、析晶而转变为亚稳型。又如醋炎痛的五种晶型中,Ⅰ、Ⅱ和Ⅲ型不吸湿,而Ⅳ、Ⅴ型则在较高相对湿度下缓慢地转变为一水合物。而甲基泼尼松Ⅱ型当暴露于一定温度和湿度下可产生降解,Ⅰ型则较稳定。诸如此类,可见选用确定的稳定性好的晶型是至关重要的。
多晶型对药物溶出度及生物利用度的影响
药物的不同晶型,由于溶解度和溶出速率不同,从而影响生物利用度,进而导致临床药效的差异。Kristl.A等人对无环鸟苷进行溶解度及溶出速度的研究,发现无环鸟苷的两种无水多晶型物(不稳型和稳定型)溶解度有很大差异。又如H2受体抑制剂甲氰咪胍的五种多晶型物,在37℃蒸馏水中的溶解速度也表现出显著的差异。Burger,A等人对醋炎痛的多晶型及假多晶型的研究中,发现其五种晶型在BuOH和pH为6的水溶液中的溶解度有极大差异。饱和水溶液的浓度以Ⅰ<Ⅱ<Ⅳ<Ⅴ<Ⅲ型递增,而20℃BuOH饱和溶液的浓度则相应提高。
多晶型固体药物表面自由能大小是影响其溶出度的因素之一。亚稳态的非极性表面自由能与稳态晶型基本相同,但极性表面自由能大于稳态,因而总的单位表面自由能较大,更易被水润湿。在固体制剂崩解后形成的混悬液中,由于亚稳态粒子表面易水化,较厚的水化膜的反絮凝作用优于稳态晶型物,因此亚稳态的晶体粒子更易分散,从而提高了溶出度。例如难溶于水的皮质类激素,如醋酸泼尼松(PNA)及泼尼龙(PL)均存在多晶型现象。分别进行溶解度及片剂溶出度实验,发现PNA与PL的稳态与亚稳态晶型的片剂,其溶出度存在显著差异。
药物多晶型对生物利用度的影响,最典型的例子莫过于无味氯霉素(氯霉素棕榈酸酯)。无味氯霉素水溶性极差,在体内受胃肠道的酯酶水解,释出氯霉素而发挥疗效。许多研究表明,影响生物利用度的主要因素是晶型。无味氯霉素共有A、B、C三种晶型及无定形。其中B型为亚稳型,具有较高自由能,水中溶出速度比稳定的A型快得多,且易为酯酶水解而吸收,血中浓度几乎为A型的七倍。C型也为亚稳型,它易变为A型,溶出速度介于A、B之间,血浓度不高,与A型同称为“非活性型”。
我国在1975年以前生产的无味氯霉素原料、片剂、胶囊都为无效的A型,后来经过进一步研究,才改进生产工艺,生产出有生物活性的B型,并在质量标准中增加了非活性晶型的含量限度,从而提高了药品质量,确保了临床疗效。但并不是药物的多晶型物就必然在体内有显著的生物利用度差异。程卯生等对组胺H2受体拮抗剂法莫替丁的多晶型及生物利用度进行了研究。通过熔点测定、差热分析、红外光谱及X-射线粉末衍射,确定法莫替丁至少存在两种不同的晶型。测定二者口服及静注后的血药浓度,发现两种晶型片剂在健康人体内的生物利用度无显著性差异。
药物制备过程中引起晶型转变的情况
在药物制剂的生产制备过程中,许多因素会影响到晶型的转变。了解并掌握这些影响因素,有利于合理设计处方,制定工艺方案,避免产生不希望的晶型,使亚稳定型稳定化,从而保证药品质量及临床药效。
加热 药品经干燥或加热灭菌等工艺条件处理时,当达到某一特定的转变温度,可能发生晶型转变。
熔融 熔融物冷却时,可能析出多晶型物,其类型因冷却方式而异。例如无味氯霉素的生产工艺中,无效晶型A经过熔融(87~89℃)和快速冷却,即可转变为有效的B晶型。
研磨 研磨是药物制剂制备过程中极为重要的一步,它对晶型转变的影响也屡见报道。Otsuka,Makoto等人发现,头孢菌素、氯霉素棕榈酸酯及消炎痛在研磨过程中均会发生晶型转变。一般而言,研磨往往导致亚稳型向稳定型的转变,但也有例外。
混悬 混悬型液体制剂在贮存过程中常常发生晶型转变现象,如甲基氢化泼尼松、巴比妥等混悬液。
压力 片剂压片过程中,压力可能引起晶型的转变。
湿度 对于极易吸湿的晶型,微量的水分即可能引起晶型的转变。
实践证明,研究和掌握药物多晶型性质,对于处方开发、新药剂型确定前设计、生产工艺的优化、药品质量控制以及临床药效的发挥都有着极为重要的作用。许多药物多晶型与疗效、稳定性之间的关系仍有待进一步研究。
多晶型筛选和稳定型筛选
---揭开多晶型研究的神秘面纱,需要一个系统的矩阵式的设计方案(略)
多晶型筛选主要是为了发现尽可能多的结晶型(大部分为多晶型)固体,但也包括寻找水合物和溶剂化物,同时要找到多种晶型中热力学最稳定的晶型和搞清楚主要晶型之间的转变过程才算完成研究任务。多晶型筛选一般包括以下方法:
① 不同条件下重结晶:通过溶液溶解或熔化多晶型筛选一般包括以下方法。改变原始固体的结晶性,然后在一系列条件(如温度、溶剂,过饱和度、添加物等)重新结晶,观察是否有其他晶型形成。
② 检查热、湿度、机械压力等导致的固体-固体转变。
对于某一化合物,虽然筛选和发现其所有的晶型是有意义的,但发现最稳定的多晶型才是多晶筛选中最重要的一项工作。Zhang等提出了3种能更好地发现稳定多晶型的晶型筛选方法。混悬液/浆体的应用和溶液介导相转变能改进这种方法具体阐述如下:
1)重结晶
a.利用可得晶型
b.确保固体完全溶解,去除原始晶型的晶种;
c.低速下重结晶,指冷却速度低或溶剂蒸发速度低;
d.使用较宽的最终温度范围。如果采用冷却结晶法,诱导时间和亚稳定相向稳定相转变的速率随温度变化而变化。
2)重结晶后,混悬液中加入少量原始晶型,搅拌不同的时间,定期检查固相。时间长短取决于考察的化合物,如果在溶液中化学稳定性较好,则时间越长越好。
3)使用一系列性质不同的溶剂,如氢键、极性、介电常数和溶解度等不同。
在开发新的候选药物时,这种方法能提高发现稳定多晶型的概率。虽相较其他方法需要稍多的时间和精力,但这种方法技术简单,所得结果也更好。新药的开发领域,目前国内外药企或研究院所都在研究多晶型,通过原料药的晶型专利来延长药物的市场保护期;
仿制药领域,对于市场成熟的老品种,可能过去或原研厂家没有深入研究晶型,这是一个创新或者赢得市场份额的机会,新兴的品种稳定晶型受到专利保护无法仿制原研晶型,您也可以另辟蹊径,经过研究不影响药物制剂质量和疗效的前提下,选择优势的亚稳态的晶型,以规避专利问题。是利是弊自己衡量吧。具体研究方案在此就不一一展开了,有需求,请您毫不犹豫的咨询作者。
最稳定晶型的获得和晶型之间的转变方法设计操作比较容易,限于篇幅就不在此一一描述,不清楚的请咨询作者。
仿制药原研晶型的鉴定
---一个剥茧抽丝式的剖析确证过程
目前国内外对原研晶型鉴定的方法,不外乎联用以上列举的固体表征分析技术,此过程分为两个部分:1)鉴定的可行性试验;2)晶型鉴定试验。以正在成为抗凝血药领域的主流药物口服抗凝血药Xa 凝血因子抑制剂--沙班类A药为例进行简要概述。
1) 可行性试验主要从以下两方面设计:
首先要能明确区别药厂提供或自制的多晶型原料药的具体晶型,如采用粉末X射线衍射扫描和显微镜观察,发现厂家提供的原料药有两种晶型,晶型I和晶型II。
图1原料药晶型I和晶型II的粉末X射线衍射对比图谱
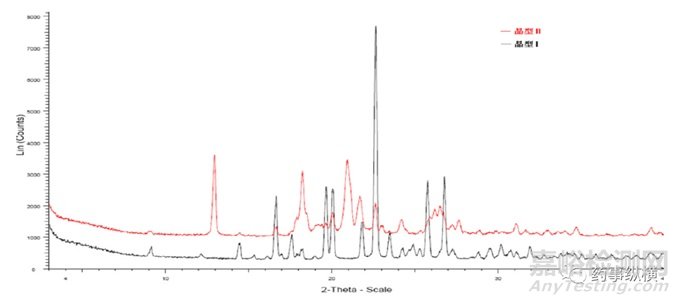
图2 原料药的显微镜观察结果

使用粉末X射线衍射分析仪(PXRD)对厂家提供的自制原料药的晶型(I型和II型)进行测试分析,结果显示晶型I和晶型II 是两种不同的晶型(图1)。偏光显微镜结果(图2)也表明晶型I和晶型II外貌形态不同,也进一步证实晶型I和晶型II为两种不同的晶型。
其次,测定辅料对原料药粉末X射线衍射(PXPD)的干扰情况:
将各个辅料分别称取10 mg进行高精密度粉末X射线衍射测定(图3),结果显示7种辅料中一水乳糖、硬脂酸镁、十二烷基硫酸钠和包衣粉为晶体物质,其他3种为无定形物质,其中硬脂酸镁与十二烷基硫酸钠含量微小,对鉴定几乎没有影响。同时,从XRPD图谱中可以挑选出5个衍射峰为晶型I的特征峰,2θ分别为:
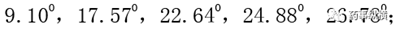
3个衍射峰为晶型II的特征峰,2θ分别为:
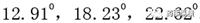
在无原研片处方的情况下,为模拟处方,假设原料药含量为10%,结果表明原料药含量为10% 时,PXRD图谱中包括所有原料药晶型I(或晶型II)的特征峰,因而该方法可以精确地鉴定出原料药的晶型。
图3 原料药和各辅料的粉末X射线衍射对比图谱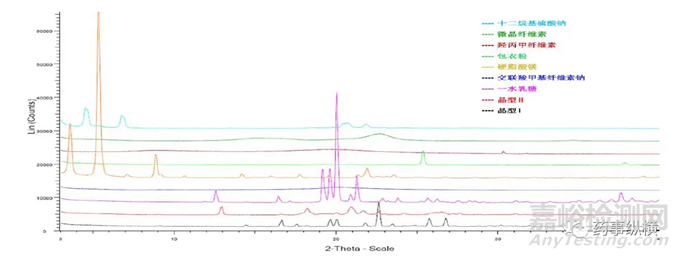
2) 晶型鉴定
先仔细地剥去原研片薄膜包衣层,将药片用研钵碾碎。将碾碎后的药物粉末称取一定量,在一定扫描速度和步长下进行PXRD衍射。将此结果与其晶体类辅料的PXRD图谱对比分析,结果初步表明原研片中的原料药的晶型为晶型I。
由于一水乳糖对原研片中原料药的特征峰干扰较大,为确证推断的可靠性,因此采用水洗过滤去除乳糖后,再次进行PXRD的测试,将此结果与两种晶型的原料药、去除包衣的原研片及一水乳糖的PXRD图谱进行对比分析,发现更容易找出原料药晶型I的特征峰,而晶型II的两个较大的特征峰(12.91o,18.23o)没有存在的迹象。
另外,采用排除法进一步确证了原研片中原料药的晶型不是晶型II。分别将含10% 的晶型I或晶型II的自制模拟处方的PXRD图谱与两种晶型原料药、去除包衣的原研片及一水乳糖的PXRD图谱进行对比分析,发现含10% 的晶型II的自制模拟处方样品在晶型II的特征峰位置很容易识别出其特征峰,而原研片图谱中找不到其信号较强的特征峰。为确保测量结果的重复性,每次称取固定量的原研片样品,用开发好的精确缓慢的扫描速度和步长进行测试,共测试3次。结果显示用此方法测试的重复性很好。
图4 排除法确认原研片中原料药晶型的粉末X射线衍射对比图谱
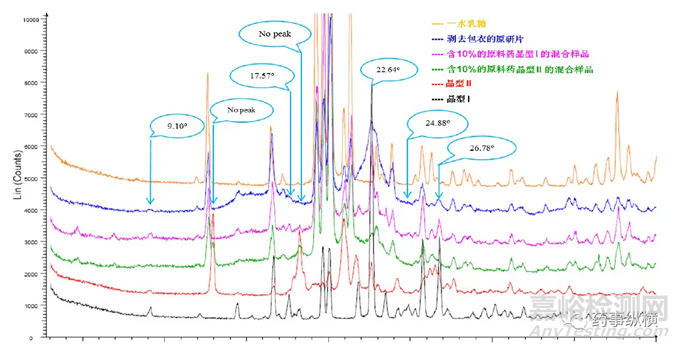
图5 重复性测试原研片的粉末X射线衍射对比图谱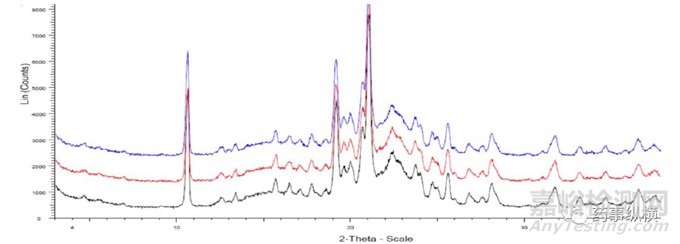
晶型研究的过程不复杂,时间和经济成本也不是很高昂,必要性关键是政策导向和企业高管的认知和重视程度,研究是蜻蜓点水还是深度全面展开研究?我想经过我前面的论述,还没有给予高度关注的药企,多晶型研究的重要性需要提上日程和付诸行动了......
参考文献:
1. ThrelfallTL. Analysis of organic polymorphs. Analyst [J] (Cambridge, U.K.), 1995,120(10):2435
2. 刘崇悌. 药物的晶型改变与晶癖以及它们对药品质量及临床药效的重要影响[J]. 国外医学.药学分册, 1980, 4: 207
3. 仿制药晶型研究的技术指导原则。
4. 固体口服制剂的研发——药学理论与实践,邱怡虹等译。
5. Pudipedd,M.&Serajuddin,A.TM.(2005).Trends in solubility ofpolymorphs. J.
Pharm.SCI.94,929-939.
6. OtsukaM, Kaneniwa N. Effect of mechanical treatment on the physicochemical propertiesof bulk powders for pharmaceutical preparations[M]. Proc Jpn-Sov Symp Mechanochem,2nd, 1988: 209
7. Otusuka M, Matusuda Y. The role of grinding in the design of pharmaceuticaldosage forms[J]. Pharm Tech Jpn, 1990, 6(8): 977
8. RostonDA, Walters MC, Rhinebarger RR, et al. Characterization of polymorphs of a newanti-inflammatory drug[J]. JPharm Biomed Anal, 1993, 11(4-5): 293
9.Matzger,A.J.(ED.),(2008).Facets of polymorphism incrystals.Cryst.Grow.Design8,2-161.
10.Burger A, Lettenbichler A. Polymorphism and pseudopolymorphism ofacemetacin[J]. Pharmazie, 1993,48(4): 262
11.Kristl A, Srcic S, Vrecer F, et al. Polymorphism and pseudopolymorphism:influencing the dissolution properties of the guanine derivative acyclovir[J]. IntJ Pharm, 1996, 139(1,2): 231
12. Kitaoka H, Wada C, Morli R, et al. Effect of dehydration on the formationof levofloxacin pseudopolymorphs[J]. ChemPharm Bull, 1995, 43(4): 649

来源:Internet


