您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2024-10-20 13:25
一、实验原理
MTT实验的原理依赖于细胞内琥珀酸脱氢酶的活性。这种酶能催化MTT分子在细胞内的还原过程,形成水不溶性的蓝紫色结晶甲瓒(Formazan),并沉积在细胞中。活细胞具有此酶的功能,因此能够产生甲瓒结晶,而死细胞缺乏这种功能。二甲基亚砜(DMSO)被用来溶解细胞内的甲瓒结晶。通过酶标仪在490nm或570nm波长处测定甲瓒溶解后的光吸收值。
在一定细胞数量范围内,MTT结晶形成的量与细胞数成正比。因此,透过测定的光密度值(即OD值),我们能够推断出活跃细胞的数目。高OD值代表着细胞的活性较高,而低OD值可能意味着细胞数量较为稀少或者细胞的活性较为低下。在药物毒性评估方面,高OD值则意味着药物的毒性较小。
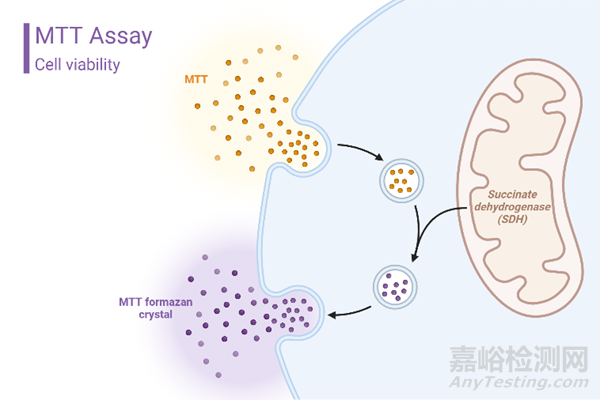
主要用途:
1、评估细胞活性和增殖能力:MTT实验可用于评估细胞的活性和增殖能力。通过测量MTT还原产生的紫色产物的形成量,可以间接反映细胞的代谢活性和增殖状态。
2、药物筛选和药物毒性评价:MTT实验广泛用于药物筛选和药物毒性评价。可利用MTT实验来测试候选药物的抗癌活性、抗炎活性等,并评估药物对细胞的毒性和安全性。
二、实验步骤(以贴壁细胞为例)
1、重悬细胞:将贴壁生长的细胞经胰酶消化处理,以获得单个细胞的悬浮液。使用含有10%胎牛血清的培养基调整细胞悬浮液的浓度,以确保细胞在接种后能够良好地生长和繁殖。
2、接种细胞:将每毫升细胞悬浮液中含有103至104个细胞的数量接种到96孔板中。每个孔加入200微升的细胞悬浮液,确保每个孔内细胞的均匀分布。
3、添加受试药物培养细胞:将96孔板置于37摄氏度、5%二氧化碳的培养箱中培养,使细胞贴壁生长。随后,加入不同浓度的药物,培养时间根据实验需要确定,一般为2至3天。
4、呈色:向每个孔中加入20微升的MTT溶液,使MTT的最终浓度为0.5毫克/毫升,继续培养3至4小时。这将导致MTT浓度从5.0毫克/毫升降至0.5毫克/毫升,并使细胞内的活细胞能够将MTT还原为紫色的甲瓒形成,吸取96孔板每个孔的培养液,每孔加入150微升DMSO,低速振荡10min溶解结晶。
5、比色:使用酶联免疫检测仪测量每个孔的吸光度值。测量时,波长为490nm或570nm。
6、结果计算:
计算细胞增值率:测得各组的OD值后,求每组的平均值,再用以下公式计算各组的细胞增殖率:细胞增殖率(%)=加药组OD值/对照组OD值×100%
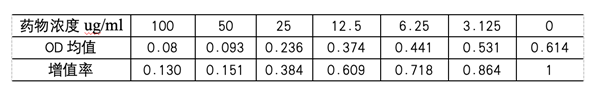
如对于100ug/ml的药物,其增殖率=0.080/0.614=0.130。
三、注意事项
1、设置空白对照组:为了确保准确性,需要将空白对照孔(含有培养基、MTT和二甲基亚砜的孔)设置为零吸光度。这样可以消除由培养基和试剂本身引起的背景吸光,使测量结果更为准确。
2、确定细胞接种浓度:细胞接种时的浓度选择对实验结果具有至关重要的影响。如果浓度过低,可能导致信号过于微弱,而浓度过高则可能因为细胞之间的相互干扰而干扰结果的准确性。应根据细胞的生长速度和特性,选择适当的接种浓度。
3、MTT试剂的保存应避光,而在加入MTT试剂时,如果采用排枪或速度较快的操作,则不必过于担心光照的影响。然而,若需要进行长时间的操作,则务必确保在避光条件下进行,以免光照对试剂产生影响。
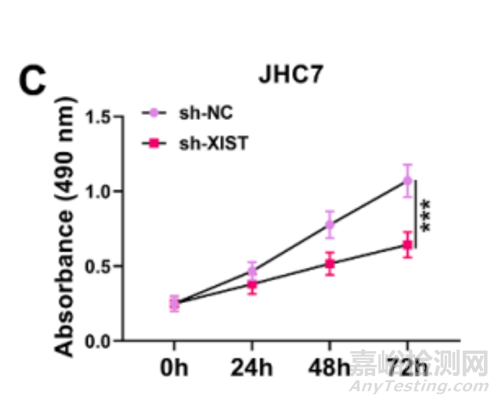
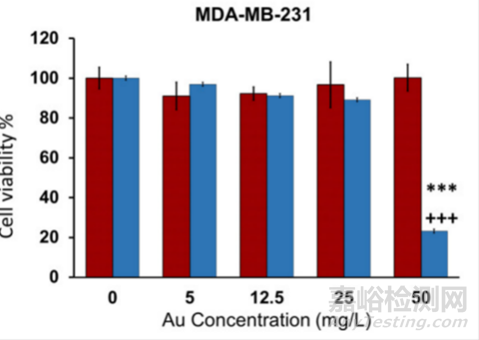
如图所示为MTT实验测不同处理组的细胞活性

来源:实验老司机


