您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-10-23 08:22
引言:根据美国食品药品监督管理局(FDA)的数据,截至 2023 年 12 月 31 日,CDRH 和 CBER 已授予 933 种突破性器械称号。然后获批的仅有95家,可见美国FDA突破器械认定的含金量以及获批的高难度。本文结合自己在申报FDA突破性器械(成功)的一些思考撰写本文,介绍了FDA突破性器械申报中的常见问题,如难度如何、要不要找中介、申报的重点、申报的底层逻辑思考,期待能够为诸君提供点滴参考。
第一部分:申报前的三个问题
1.对比国内创新医疗器械申报资料撰写复杂程度如何?
之前作者也结合自己申报国内创新医疗器械的成功经验撰写过《浅谈创新医疗器械申报资料撰写的重点》和《呕心沥血篇|浅谈创新医疗器械专家咨询会答辩准备事宜及关注要点》,感兴趣的可以看一下。对比国内的创新医疗器械,单独从材料的撰写和内容的充实度来看,撰写要简单一些。为什么这么说呢?我们可以看下国内创新医疗器械的申报资料的要求:
资料应当包括:
(一)申请人企业资质证明文件。
(二)产品知识产权情况及证明文件。
(三)产品研发过程及结果综述。
(四)产品技术文件。
(五)产品创新的证明性文件,至少应当包括:
1.核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;
2.国内外已上市同类产品应用情况的分析及对比(如有);
3.产品的创新内容及在临床应用的显著价值。
(六)产品风险分析资料。
(七)产品说明书(样稿)。
(八)其他证明产品符合本程序第二条的资料。
(九)所提交资料真实性的自我保证声明。
《创新医疗器械特别审批申报资料编写指南》
而对于FDA突破器械的申报资料,可以说简单到令人发指,就一个word就搞定啦,字数都不到1万字,是不是难以想象?其实一开始我也觉得会很复杂,要写很多资料。但到最后,我发现其实其实,更简单到让人难以想象的其实就是一张表?你能相信吗?的确是一张对比表,如果那种对比表搞定了,其实内容就搞定了很大一部分啦。
2-申报的难度与国内创新医疗器械的对比如何?
我门首先看一组数据,2个图对比下我国与美国创新器械的认定量差异性:
根据美国食品药品监督管理局(FDA)的数据(图1),截至 2023 年 12 月 31 日,CDRH 和 CBER 已授予 933 种突破性器械称号,其中包括最初根据EAP)计划指定的器械。在 933 种被授予“突破性器械”称号的器械中,CDRH 授予了 921 种,CBER 授予了 12 种。根据NMPA数据,我国2014-2023年10间共计有488项医疗器械进入创新医疗器械审查程序(图2)。可见FDA突破性器械认定的数量是远高于NMPA的创新医疗器械,简单来看是更容易些,但FDA突破器械申请的国际化程度更高一些。别的方面不说,单独对于申报材料而言,个人认为FDA突破性器械认定申报材料对于逻辑性的要求更高。

图1 美国FDA获得突破器械的认定数量
*数据包括根据前身快速访问途径 (EAP) 指定的设备。由于前身 EAP 计划和突破性器械计划之间的愿景和指定标准是一致的,FDA 认为根据 EAP 授予指定的器械是突破性器械计划的一部分。**表示2024年的数据是从2023年10月1日到2023年12月31日。

图2 我国创新医疗器械认定及获批情况
3.要不要找中介?
如果有钱建议找(你懂我要说啥~),因人而异,也因申报中介而已。最最关键的,要找能够吃透你产品的人,否则中介也没有用。
说实话,我们最开始也找了(这里就不写名字啦),我本以为我就可以放心了,不用咱们操心啦,结果与团队伙伴一起整了2个月初稿都没有搞出来,后来也只能自己去梳理逻辑证据链重新自己下手去搞。出来混迟早要还的,该吃的亏一个少不了。
如果非要找,建议找曾经搞过这一类产品的,同时医学团队一定要一些,逻辑性一定要强,否则就是花冤枉钱了。
第二部分:FDA突破性器械申报的底层思考
1.最重要的是什么?——这也是我们申报的起点
首先我们看下FDA突破器械认定的要求:
1-该设备可以更有效地治疗或诊断危及生命或不可逆转地使人衰弱的人类疾病或状况
2-该设备还至少满足以下条件之一:
a.代表突破性技术
b.不存在批准或清除的替代方案
c. 与现有已批准或已批准的替代方案相比具有显著优势
d. 设备可用性符合患者的最佳利益
https://www.fda.gov/medical-devices/how-study-and-market-your-device/breakthrough-devices-program
从上面的要求,我门不难看出,其实要求只有2条,所以我们的最重要的,或者说底层的逻辑也就2条:
(1)证明产品的适应证是疾病是属于危及生命或不可逆转地使人衰弱的人类疾病或状况 ;
(2)证明自己产品的优势:没有替代方案或者比替代方案更有显著优势;(别问我为啥不说另外2条,因为作者也不会~)
关于第一条:我想有一百种办法(就像你有一百种办法帮我把这篇文章分享出去一样~)去证明你治疗的疾病是满足FDA说的危及生命获不可逆转的使人衰弱的人类疾病的,这里我就不赘述了。当然如果你实在想不到,那可能这个产品真的不适合报了,就放弃吧。或者是因为写的人不适合,公司不具备这样的人才,那就放弃吧。
刚才我说的简单到一张表,其实就是对比自己产品与替换方案的更有显著优势在哪里?看到这里是不是有些懵,这个怎么证明啊,怎么证明我们的产品比别人更有优势?这里停留10秒钟,先不要往下看~~~
~~~~~华丽的10秒分割线~~~~~~
让我猜一猜你想到的是什么:
是自己产品的设计优势吗?
是产品物理性能更牛吗?
是产品材料和设计对比吗?
还是临床效果对比?
如果是临床效果对比,又有哪些对比维度呢?
如果你想到最后一条,那么恭喜你!
2-那一张表到底该怎么对比?
看到这里的伙伴,恭喜你讲到花钱也买不到的智慧啦。如果你想要模版我想告诉你没有(如果你硬要,那我就给你画一个~),这个表是自己设计的,但我可以告诉设计的方法,而且不要钱~,白拿。
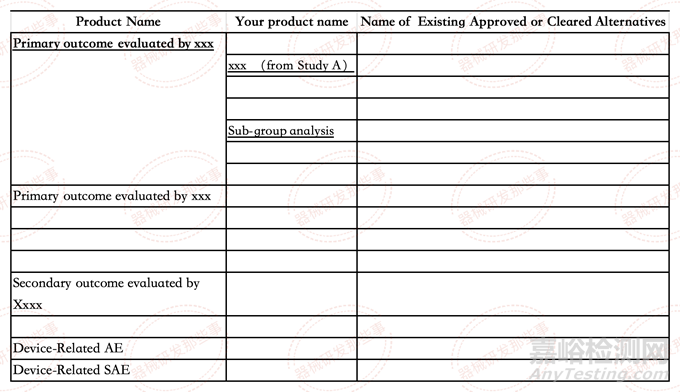
我们首先思考一个问题,我要证明产品比替代方案有显著的优势,应该从患者的思考,而不是从产品的角度思考,也就是我之前分享的一个观点,产品的核心价值=谁+问题+解决方案,我们应该从谁的角度思考这个问题。那么问题就简单了,我们要去对比显著优势,最好的办法其实是临床评价,也就是临床试验的设计维度去对比,按照主要评价指标,次要评价指标,次次要评价指标一一逐项对比差异性,挖掘最最优势的地方。
产品的核心价值 = 谁 + 问题 + 方案。
《互联网产品方法论》:怎样定义产品的核心价值
3-主要评价指标哪里来?
这个问题非常关键,如果选择不好,基本可以说就废了,因为你和别人对比的维度都没有选对,可想而知结果如何。所以这个一定要非常非常非常再非常的谨慎选择。不要觉得自己的产品优势太多了,既能够治疗这个,又能够治疗那个,像是万能的。这种的万能其实就废品,一样也不能。所以你到底要对比啥,自己的思考清楚,你的适应证到底是啥,围绕适应证去思考你的对比维度。
个人强烈推荐找指南或者临床评价指标原则或替代方案的临床设计方案。为什么是这个逻辑呢?因为这些是证明替代方案产品临床效果最直接的证据和维度,也是最权威的维度,所以你不要胡思乱想了,抓住这个维度主线去狠狠的挖掘你产品的优势。如果这样对比都没有优势,那么你的产品也不太适合,甚至可能最后都获批不了。因为你的临床试验设计可能是失败的,都不符合指南获评价指导原则的要求,那就没有必要了。
如何将指南或临床评价指标与自己的产品对应起来,我想这并不是十分困难的事情,这里就不赘述了。关于查找临床方案之前撰写过「全网最全」全球医疗器械临床试验查询网站大全,可参考进行。
第三部分:FDA突破性器械申报的建议
1-如何开始?
先梳理好证据链,再进行撰写。这是申报的起点,也是申报最最重要的支撑,也是决定成败的支撑,所以开始并不着急收集资料,撰写材料。
2-多少临床数据就够了?
这个没有标准,作者这次申报就5例也成功了,当然运气成分比较多。数据多少是一方面,最主要的还是你的逻辑链条。如何证明你的显著优势,用什么样的逻辑链条去证明这件事,才是最关键的。
3-替代方案写那些?
替代方案不是写的越多也好,同时这个替代方案不是指你的同类产品,而是上升到这个疾病的解决方案。建议写获批的,其余的概括介绍,不要觉得自己的技术有多么牛逼,就介绍了一大堆相关的技术,一个也没有获批,都是应用前景,那么写再多也没用意义的,毕竟你没有获批,写上一万个好技术,不如写清楚一个获批的。要搞清楚咱们的目的不是介绍综述,而是介绍已存在的获批的对于这个疾病的替代解决方案。
4-对比一定选择器械吗?
这个问题作者也曾面临过艰难的抉择,作者面临的课题是:器械没有获批,但获得FDA突破性器械,同时唯一一个药物获批。如果是你,你该怎么选择?按照行业常规操作,优选同类产品。最终作者放弃了器械作为对比替代方案,选择了药物。底层的逻辑还是那个公示,产品的核心价值=谁+问题+解决方案,要站在谁的问题去思考,尽管那个器械获得了FDA突破性器械认定,但是毕竟没有获批,对于谁的这个问题回答不了,解决不了其风险和收益的问题,因此作者最终选择了获批的药物进行。
但这个问题同样存在致命的缺陷,那就是器械的AE肯定比药物的AE要多的多,压根不在一个对比维度上,那么如何解决这个问题呢?
答案也藏在那个公示的底层思考里。那就是寻找已批准的其他同类器械在其他适应证的不良反应,如果能够证明我们的AE比它低,这个逻辑链条就完整了。
结束语:本文结合作者申报FDA突破性器械的成功经验,介绍了FDA突破性器械申报中的常见问题,如难度如何,要不要找中介,申报的重点,申报的底层逻辑思考,申报的建议等维度提出了一些思考和建议,期待能够为诸君提供点滴参考。

来源:器械研发那些事


