您当前的位置:检测资讯 > 检测案例
嘉峪检测网 2024-11-19 11:52
变更的原因和计划
1、由于之前的供应商计划不再生产该类玻璃瓶,因此需要增新的供应商
2、变更之前的工作:
(1)预计变更实施的时间:
a.根据生产计划备货,确保至变更关闭之前的生产计划
b.初步制定变更的启动和各项工作的开展计划
(2)初步筛选适合的新供应商:
a.资质满足要求,能生产所需要的材质和型号的玻璃管制瓶;
b.已经在同类产品上得到广泛应用;
c.供货水平、价格适合
3、确定变更的具体内容,是否同时关联其他变更
一、初步评估确定变更级别
依据《已上市生物制品药学变更研究技术指导原则(试行)》,前提条件满足以下情形为微小变更:
1、未改变包装材料和容器的材质、类型
2、与制剂直接接触的包装材料和容器形状、尺寸未发生变更或等效(如在不改变内部尺寸的情况下增加玻璃瓶厚度等)
3、不影响产品的稳定性
4、包材已经批准或者包材已备案且登记状态为A
二、评估对产品可能的影响和需要开展的工作
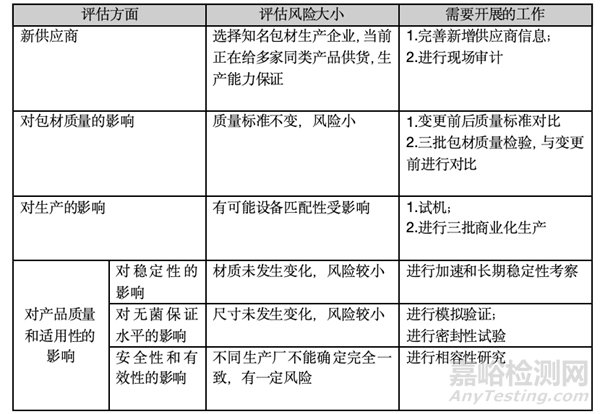
三、各项研究结果确认
1、供应商选择
(1)管制瓶登记状态为A;三批全检质量符合要求
(2)供应商审计符合要求
2、按照批准的工艺进行连续三批生产(使用三批包材)
(1)生产过程和各项参数、过程控制结果与变更前一致;
(2)变更前后产品质量无明显差异;
3、稳定性研究
(1)进行加速和长期稳定性考察;
与变更前进行对比,各考察时间点结果和整体趋势无明显差异
(2)按照稳定性考察方案继续研究
4、相容性研究(委托外部实验室进行)
(1)进行可提取物、浸出物研究,结果均低于限值;
(2)玻璃内表面脱片测试,未观察到侵蚀脱片的情况
5、密封性研究
(1)采用微生物挑战法验证合格
(2)真空衰减法验证合格器的材质、类型、
四、药学研究资料整理提报
1、新旧供应商证明文件
2、工艺补充验证报告复印件
3、连续三批产品的检验报告单
4、变更前后制剂长期稳定性试验图谱
5、变更前后制剂加速稳定性考察图谱
6、相容性研究报告的复印件
7、密封性验证报告的复印件

来源:医械铁锅炖


