您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-12-02 09:18
美国 FDA 于 11 月 26 日发布了《药物(活性成分)或代谢物 Ames 阳性情况下为支持健康受试者中首次人体临床试验而建议进行的后续测试》指南草案,详细说明了其关于如何以及何时可以对具有致突变潜力的药物进行首次人体试验(FIH)的想法。
如果之前的测试显示对健康试验对象的风险很小,FDA 将采取基于风险的方法,允许开发某些致突变产品。FDA 建议申办人对 Ames 阳性药物活性成分进行后续体外和体内致突变试验。
FDA 将基因毒性测试定义为体外和体内测试,旨在识别诱导基因损伤(致突变性或致染色体断裂性)的化合物。这些测试可以帮助利益相关者了解药物造成 DNA 损伤及其固定的可能性。
FDA 表示,“基因毒性测试在药物开发的研究性新药申请(IND)阶段对保护临床试验对象免受潜在增加的基因毒性危害和癌症风险起着重要作用。通过 ICH 咨询程序,行业和监管机构已经接受了一系列标准的遗传毒理学研究。”
FDA 列出了几篇 ICH 指南,包括 ICH M3(R2),并建议进行致突变性测试以保护试验对象,这些测试通常在 I 期试验开始前或至少 II 期试验之前进行。通常,大多数被发现具有致突变性的药物不会进一步开发以获得 FDA 批准。然而,某些药物,由于其治疗作用机制,尽管具有致突变潜力,还是可能会被 FDA 允许进一步开发。
指南指出,“指南就 Ames 阳性药物活性成分的后续测试提出了建议,以应对申办人决定继续开发的罕见情况。这些建议旨在在健康人类受试者中进行 FIH 试验之前解决和降低某些安全问题。”
“后续测试不能完全缓解 Ames 阳性结果引起的担忧,而且在缺乏充分的致癌性评估的情况下,仍存在一些残留风险。因此,进一步开发的 Ames 阳性药物活性成分应该是针对严重或危及生命的疾病且医疗需求未得到满足的情况。”
指南指导申办人应如何分析他们的 Ames 测试数据,并在测试结果为阳性时进行后续测试。指南还详细介绍了对 Ames 阳性药物或代谢物进行证据权重 (WoE) 评估。FDA 绘制了一棵决策树,申办人在考虑对健康试验对象使用 Ames 阳性产品时进行 WoE 评估时可以使用。
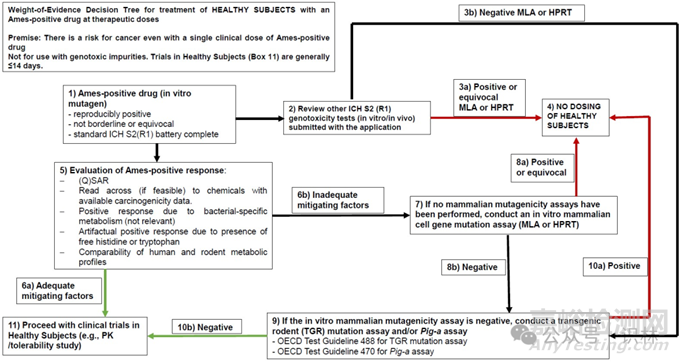
图1:Ames阳性药物(活性成分)的后续试验决策树
FDA 表示,只有当先前广泛的后续测试结果根据 WoE 评估降低了癌症风险时,才可能考虑允许将 Ames 阳性药物活性成分用于健康受试者。
“体外哺乳动物细胞基因突变试验和体内基因突变试验都需要为阴性,才能考虑对健康受试者进行 FIH 试验。如果体外哺乳动物细胞基因突变试验或体内基因突变试验为阳性,则不支持对健康受试者进行 FIH 试验。”
指南建议,希望在健康临床试验受试者中使用 Ames 阳性产品的申办人应通过 FDA 药品评估和研究中心 (CDER) 的 IND 前流程与相应部门的审评人员沟通。该指南适用于小分子药物活性成分的开发,生物制品、晚期癌症患者用药和 DNA 反应性(致突变性)杂质不在本指南的范围内。

来源:识林


