您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-12-11 08:29
一、基本概况
1、自然环境
香港是中华人民共和国特别行政区,位于中国南部、珠江口以东,西与中国澳门隔海相望,北与深圳市相邻,南临珠海市万山群岛,距广州市约200公里。区域范围包括香港岛、九龙、新界和周围的262个岛屿。据香港地政署数据,2022年底,香港特别行政区海陆总面积2754.97平方公里。香港陆地总面积为1114.35平方公里,其中香港岛80.72平方公里,九龙46.93平方公里,新界及离岛986.7平方公里。香港海面总面积(包括维多利亚海港)为1640.62平方公里。
2、人口和行政区划
截至2022年底,香港居住人口为734.61万人,其中男性335.45万人,女性399.16万人。香港是世界上人口密度最高的地区之一。中、英文同属香港的法定语言。政府机关、法律界、专业人士和商界均广泛使用英文。香港不乏受过良好教育且精通三语(即英语、粤语和普通话)的专才,对于在香港经营业务或与内地、台湾地区有贸易往来的企业,这些专才十分重要。
香港可分为香港岛、九龙、新界东、新界西四部分,又可分为18个区。香港岛:中西区、湾仔区、东区、南区;九龙:九龙城区、油尖旺区、观塘区、黄大仙区、深水埗区;新界东:北区、大埔区、沙田区、西贡区;新界西:元朗区、屯门区、荃湾区、葵青区、离岛区。
3、2024年出口概况
香港是亚洲乃至全世界最具经济活力的地区之一。2024年1-10月,内地向香港出口医疗器械72.93亿人民币,同比下降29.72%。
二、医疗仪器行政管理机构和制度
香港特别行政区政府尚未立法管制医疗仪器的进口和销售事宜;卫生署参考GHTF于2003年7月发布了《医疗仪器的规管》,并于2004年7月成立了下属机构医疗仪器科(前称医疗仪器管制办公室),负责推行医疗仪器行政管理制度,及制定长远的医疗仪器法定规管架构。
医疗仪器行政管理制度(MDACS):
◆ 医疗仪器表列制度:医疗仪器制造商和进口商和分销商根据这个制度自愿向卫生署表列其医疗仪器;
◆ 医疗事件呈报制度:制造商、进口商、使用者和公众通过这个制度,向卫生署报告有关医疗仪器的医疗事件,以便作出评估,防止医疗事件的重演。
三、医疗器械定义
根据“[GN-00] 医疗仪器行政管理制度中的定义及缩写指南”
1)一般医疗仪器定义为:意指制造商拟用於人体作以下一項或多項特定用途的任何器材、设备、工具、机器、器具、植入物、体外试剂或校准器、软件、物料或其他类似或有关物品(无论是单独或以组合形式使用):
◆ 诊断、预防、监察、治疗或减轻疾病;或
◆ 诊断、监察、治疗、减轻伤势或为补偿因伤而受损的功能;或
◆ 检验、替补、调节或维持身体结构器官或生理过程;或
◆ 维持或延续生命;或
◆ 控制受孕(包括避孕);或
◆ 消毒医疗仪器;或
◆ 为从人体抽取的样本进行体外检验或诊断,以提供资料作为医学用途;而这些仪器并非透过药物、免疫或新陈代谢的途径在人体内或人体上达到主要的原拟作用,但可通过这些途径助其发挥原拟功能。
2)体外诊断医疗仪器定义为:意指制造商拟用以为从人体抽取的样本进行体外检验的医疗仪器(无论是单独或以组合形式使用),以纯粹或主要提供有关诊断、监察或相容性测试用途的资料。意指制造商拟用以为从人体抽取这包括试剂、校准剂、对照材料、样本容器、软件及相关的器材或设备,又或其他物品。
四、产品分类
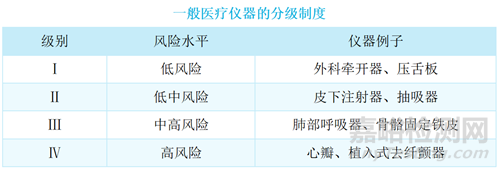
根据“[TR-003] 一般医疗仪器分级”,一般医疗仪器可为Ⅰ、Ⅱ、Ⅲ及Ⅳ级,如下表。
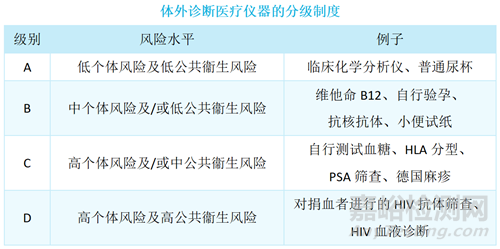
根据“[TR-006] 体外诊断医疗仪器分级”,体外诊断医疗仪器可分为A、B、C及D级,如下表。
五、注册流程
1、注册流程图
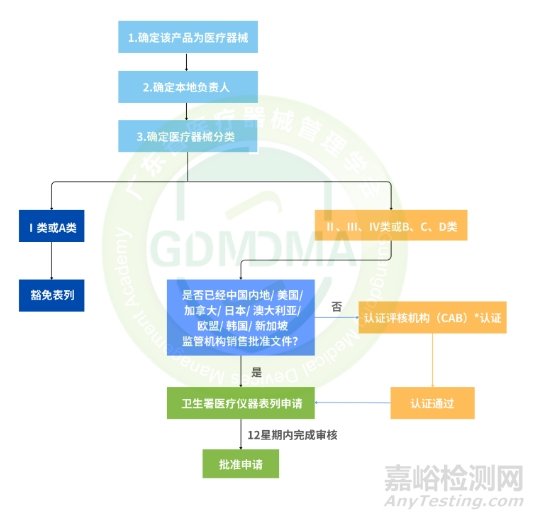
*注:当地符合资质的认证评核机构(CAB)有BSI、SGS及TÜV SÜD三家(必须是香港本地的CAB)。
2、注册提交文档
1)医疗仪器表列申请文档
一般医疗仪器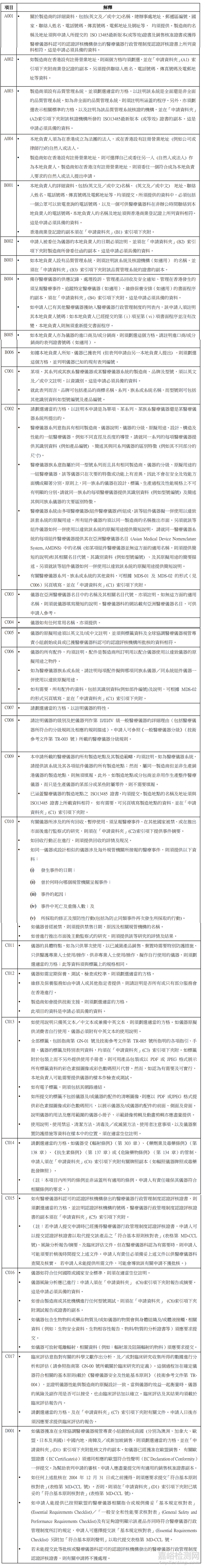
体外诊断医疗仪器
2)CAB认证评核申请文档:视具体CAB要求及产品而定。
3、注册周期及费用
1)医疗仪器表列:免费,12个星期内完成审批;表列有效期为5年。
2)CAB认证评核:需收费,实际费用及审核周期视具体CAB及产品而定。
4、医疗仪器表列申请提交
电子服务平台医疗仪器资讯系统(MDIS)(只提供英文版):业界一站式按照医疗仪器行政管理制度申请医疗仪器和贸易商表列,并呈报与医疗仪器相关的安全警示和医疗事件。
5、现场审核要求
医疗器械表列申请过程无现场审核要求,CAB认证评核是否安排现场审核视具体CAB要求及产品类型而定。
6、本地负责人
本地负责人资质要求:
1)须为在香港成立法团的法人,或在香港有商业登记的自然人或法人。
2)须为医疗仪器的制造商,或获得仪器制造商支持以履行作为该仪器的本地负责人所承担的责任。
注:①申请表列本地负责人。这项申请须连同医疗仪器表列申请一并递交MDIS。②本地负责人如需参与销售行为,如同时担任进口商或分销商角色,需先向卫生署进行进口商或分销商表列申请。

来源:广东省医疗器械管理学会


