您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-12 16:11
一、基本概况
1、自然环境
菲律宾位于亚洲东南部。北隔巴士海峡与中国台湾省遥遥相对,南和西南隔苏拉威西海、巴拉巴克海峡与印度尼西亚、马来西亚相望,西濒南海,东临太平洋。共有大小岛屿7000多个,其中吕宋岛、棉兰老岛、萨马岛等11个主要岛屿占全国总面积的96%。海岸线长约18533公里。属季风型热带雨林气候,高温多雨,湿度大,台风多。年均气温27℃,年降水量2000-3000毫米。
2、人口和行政区划
菲律宾人口约1.17亿(2022年)。马来裔占全国人口的85%,主要民族包括他加禄族、伊洛戈族、邦板牙族、维萨亚族和比科尔族等;国语是以他加禄语为基础的菲律宾语,英语为官方语言。
全国划分为吕宋、维萨亚和棉兰老三大部分。全国设有首都地区、科迪勒拉行政区、棉兰老穆斯林自治区等18个地区,下设81个省和117个市。首都是马尼拉(Manila),人口1846万(2020年10月)。
3、2024年出口概况
菲律宾为出口导向型经济,对外部市场依赖较大。2024年上半年,中国向菲律宾出口医疗器械总计约30.62亿元人民币,同比下降16.48%。
二、菲律宾医疗器械监管机构和法规要求
菲律宾的医疗器械注册是由卫生部(DOH)下属的器械监管、辐射健康和研究中心(Center for Device Regulation, Radiation Health and Research, CDRRHR)监管。
菲律宾医疗器械注册需要遵循医疗器械第 9711 号《共和国法案》,也称为“2009年食品药品监督管理局(FDA)法案”监管要求。
在菲律宾境内从事医疗器械(Medical Devices)的企业需要从菲律宾食品药物管理局(PFDA)获得经营许可证(LTO)和产品注册证书(CPR)。
三、医疗器械定义
医疗器械是指制造商有意单独或组合用于人类的一个或多个特定目的(诊断、预防、监测等)的任何仪器、设备、工具、机器、装置、植入物、体外试剂或校准品、软件、材料或其他类似或相关物品。诊断、预防、监测、治疗或缓解疾病;诊断、监测、治疗、缓解或补偿伤害;调查、替换、修改或支持解剖学或生理过程;支持或维持生命;预防感染;控制生育;消毒医疗器械;以及通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。不能通过药理作用在人体上实现其主要预期作用, 免疫或代谢手段,但这些手段可能有助于其预期功能。
体外诊断试剂是指用于诊断疾病或其他情况,包括确定健康状态的试剂和系统,以治愈、减轻、治疗或预防疾病或其后遗症。
体外诊断试剂分为可注册和不可注册。目前,只有9种IVD医疗器械被认为是可注册的,具体如下:
1. HIV(抗体和/或抗原)、HBV(HBsAg 和其他标志物)、HCV(抗体和/或抗原)和梅毒试剂盒
2. 用于替代药物的单一或联合药物筛选检测试剂盒/试剂
3. 抗A、抗B、抗D、抗AB的血型血清
4. 抗人球蛋白试剂
5. 酶、LISS和白蛋白等增强剂
6. 交叉配血和血型的色谱柱凝集试验
7. 验孕棒/试剂
8. 钩端螺旋体病检测试剂盒/试剂
9. 采血管
四、产品分类
◆ 分类依据
根据东盟医疗器械指令ASEAN Medical Device Directive(ASEAN),医疗器械和IVD的分类规定的风险分类规则,分为以下四类。
◆ 医疗器械和体外诊断试剂(IVD)分类
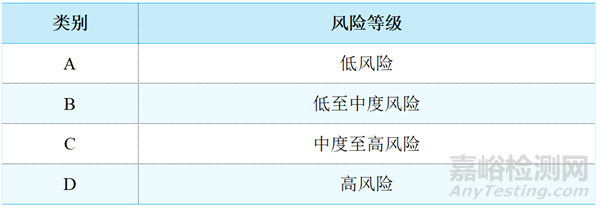
备注:医疗器械和体外诊断试剂(IVD)产品具体分类文件详见ASEAN Medical Device Directive(ASEAN)中的附件2:非体外诊断试剂医疗器械的风险分类规则2(Risk Classification Rules for Medical Devices other than IVD Devices),附件3:体外诊断试剂医疗器械的风险分类规则3(Risk Classification Rules for IVD Devices。
五、医疗器械注册要求
2019年4月1日实施的新规定要求:A类医疗器械注册颁发医疗器械通知证书(CMDN),B类、C类和D类医疗器械注册颁发医疗器械注册证书(CMDR),获证后才能在菲律宾进口并投放市场销售。新规定将分阶段实施:
1. 目前,所有A类医疗器械都必须具有CMDN,所有公告(第2021-001-A号通知中列出的)B、C和D类医疗器械必须具有CMDR。
2. 所有未经通知的(第2021-001-A号通知中未列出的)B、C和D类医疗器械必须在2024年4月1日前有一个初始CMDN,然后在更新时需要一个更相关的CMDR。
注:
a. 最初,未通知的医疗器械的截止日期为2022年4月1日,但菲律宾食品药品监督管理局已将宽限期延长至2024年。
b. 所有类别的医疗器械都需要原产国批准或参考国(美国、欧盟、加拿大、日本或澳大利亚)批准。
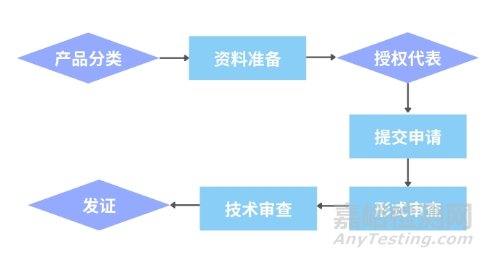
1、申请流程和资料
2、A类医疗器械提交技术文件

3、B类医疗器械提交技术文件

4、C类医疗器械提交技术文件

5、D类医疗器械提交技术文件

6、可注册医疗器械的“同情特殊许可”(CSP)申请要求
1. 意向书将包括患者的简要描述、主治医生、将执行医疗设备管理的专家名单、执行治疗所需医疗设备的数量以及医疗护理的拟议时间表。
2. 主治医师简介。
3. 如果产品将由公司供应,则需获得作为医疗器械进口商/分销商的经营许可证。
4. 如果医疗器械将由个人进口,则提供有关进口商的信息函。
5. 使用该医疗器械的原产国的医疗器械注册证书。如果该医疗器械是当地制造的,则应提供医疗器械制造商的营业执照副本。
6. 来自制造商的医疗器械技术说明,不能从公司网站下载。
7. 主治医师关于急需使用医疗器械的证明信。
8. 病人的医学摘要。
9. 申请人公司、患者亲属和主治医生应签署放弃FDA对未注册医疗器械使用引起的任何损害或伤害的责任的声明。
10. 申请人关于在患者手术或使用医疗器械后提交医学报告的承诺书。
六、注册周期及费用
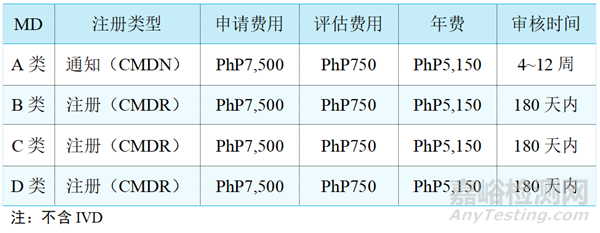
1、医疗器械注册费用及周期
2、体外诊断试剂(IVD)注册费用及周期

七、注册提交流程
1. A类医疗器械必须通过电子通知门户系统在线提交,而B类、C类、D类和IVD类医疗器械必须通过电子邮件提交。医疗器械产品注册申请的提交应遵循FDA第2020-026号通告中规定的指导方针(本通告是根据COVID-19大流行发布的,预计会随着情况的发展进行修订)。
2. 对于A类医疗器械,一旦填写了必填字段,并在电子通知门户中上传了必要的文件,申请将进行预评估。如果提交的文件都符合要求,则将生成付款顺序。注册人只有 5 个工作日的时间来处理付款。对于B类、C类、D类和IVD类医疗器械,一旦注册人通过电子邮件收到确认回执,就应付款,并且必须通过电子邮件发送付款证明,以便正式接受申请并被视为成功提交。每个分销商许可证持有者都有根据以下时间表可以提交的最大数量。
八、其他注意事项
1、现场审核要求及注意事项(质量体系要求)
A类、B类、C类和D类医疗器械均需要 ISO 13485 或FDA或日本PMDA的审核报告,以证明合法和/或实际制造设施的质量体系。
2、该区域有关UDI的要求
无特殊要求
3、特别提醒
1. 境外企业需要指定一个拥有LTO的当地经销商或指定一名合法的当地医疗器械代理人进行注册医疗器械。
2. CMDN和CMDR的有效期均为5年,在首次批准后必须每5年更新一次。延续注册可在CMDR或CMDN到期前90天内提交。
3. 根据旧规则颁发的产品注册证书(CPR)将一直有效,直至到期,届时许可证续期申请将产生新的CMDN,有效期为5年,费用为5150菲律宾比索。根据旧规则颁发的豁免证书(COE)有效期至2021年11月3日,或颁发后两年(以较短者为准)。
4. 对于CMDN/CMDR转让项目,转让申请需要注册证书原件,转让过程通常需要2到3个月的时间来处理。
注:文章内容可根据不同区域要求适当调整。

来源:广东医疗器械学会


