您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-12 18:50
一、基本概况
1、自然环境
新加坡位于马来半岛南端、马六甲海峡出入口,北隔柔佛海峡与马来西亚相邻,南隔新加坡海峡与印度尼西亚相望。由新加坡岛及附近63个小岛组成,其中新加坡岛占全国面积的88.5%。热带海洋性气候,常年高温潮湿多雨。
2、人口和行政区划
1、人口分布
新加坡总人口约592万(2023年),公民和永久居民407万。华人占74%左右,其余为马来人、印度人和其他种族。马来语为国语,英语、华语、马来语、泰米尔语为官方语言,英语为行政用语。
2、行政区划
新加坡是一个城邦国家,故无省市之分,而是以符合都市规划的方式将全国划分为五个社区(行政区),由相应的社区发展理事会(简称社理会)管理。5个社理会是按照地区划分,定名为东北、东南、西北、西南和中区社理会,这五个社区再进一步分为31个选区,包括14个单选区和17个集选区。
3、2024年出口概况
2024年1-6月,中国向新加坡出口医疗器械总计约26.60亿人民币,同比增长约5.91%。2024年1-6月,新加坡新增批准医疗器械产品总计400款,其中2款由中国企业注册。
二、新加坡医疗器械监管机构和法规要求
新加坡医疗器械监管机构为卫生科学局(Health Sciences Authority, 简称HSA)。新加坡是一个卫生医疗高度监管的国家,整个医疗器械监管框架法规体系相对完善且严格,整体要求与欧美国家贴近;其框架主要基于如下三份法案:
◆ Health Products Act 2007,简称HPA;
◆ Health Products (Medical Devices) Regulations 2010,简称医疗器械法规2010;
◆ ASEAN Medical Devices Directive 2015,即东盟医疗器械指令。
三、医疗器械定义
1、根据HPA,医疗器械定义为:
健康产品(health product)是指任何物质、制剂或器具:
(a)该物质、制剂或器具:
(i)表示供人类使用;
(ii)无论是否由于其外观或其他原因,都可能被人类使用;或
(iii)属于或通常供人类使用的物质、制剂或器具,完全或主要为与健康有关的目的;
(b)属于HPA附表1中规定的任何健康产品类别。
2、根据医疗器械法规2010,体外诊断产品定义为:
(a)是指其产品所有者打算在体外用于任何标本检查(包括任何血液或组织捐献)的任何试剂、试剂产品、校准品、参考品、试剂盒、仪器、装置、设备或系统,无论是单独使用还是与任何其他试剂、试剂产品、校准品、参考品、试剂盒、仪器、装置、设备或系统结合使用,来源于人体,完全或主要为了提供信息:
(i)关于生理或病理状态或先天性缺陷;
(ii)确定任何血液或组织捐献与潜在接受者的安全性和相容性;或
(iii)监测治疗措施;
(b)包括样本容器。
四、医疗器械产品分类
医疗器械和体外诊断产品根据其风险程度分为4类(A类、B类、C类、D类)。随着器械类别从A类到D类,监管控制强度也逐步增加,A类器械受最少的监管控制(豁免注册,列名即可),而D类器械则受到最严格的监管控制;其分类依据指南文件如下:
◆ GN-13: Guidance on the Risk Classification of General Medical Devices
◆ GN-14: Guidance on the Risk Classification of In Vitro Diagnostic Medical Devices
除了解读以上指南文件初步了解HSA的器械监管分类逻辑,同时您也可以通过医疗器械风险分类工具初步判定您产品的分类。此外,您还可以检索HSA产品列名数据库(A类)和产品注册库(B类、C类及D类),参考同类产品分类情况进一步确定您产品的分类。
◆ HSA产品列名数据库
◆ HSA产品注册数据库
如以上方式还不能帮助您确定您产品分类,您可以访问Health Product Classification Form网站申请分类界定。
特别关注:HSA允许某些满足条件的医疗器械以打包方式注册,判定依据指南文件如下:
◆ GN-12-1: Guidance on Grouping of Medical Devices for Product Registration - General Grouping Criteria
◆ GN-12-2: Guidance on Grouping of Medical Devices for Product Registration - Device Specific Grouping Criteria
五、医疗器械准入要求
1、注册流程图
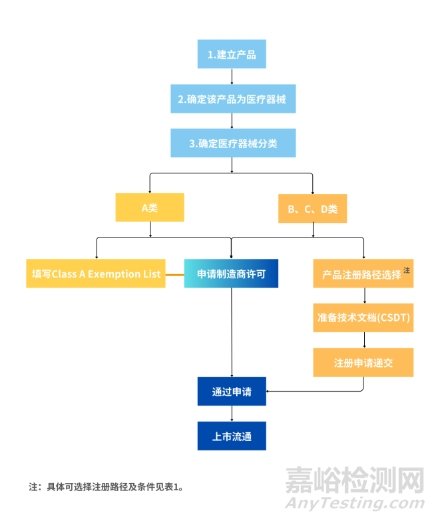

◆ B类、C类、D类具体要求
2、注册提交技术文件
1、制造商许可(Manufacturer’s License)
ISO 13485证书或MDSAP或QMS符合性声明(A类);如适用,未生产A类器械声明函。
2、A类产品列名
A类产品豁免注册,在MEDICS系统申请制造商许可时完成“Class A Exemption List”(仅需填报一些产品的基本信息,如产品名称、型号及预期用途)即可。
3、B、C、D类产品注册
文档格式采用东盟通用立卷审查技术文档模板(ASEAN Common Submission Dossier Template, CSDT),不同注册路径提交文档目录如下介绍:




注:所有文件用英文准备即可
3、注册周期及费用
制造商许可(Manufacturer’s License):费用为$1,110,周期为10个工作日。
产品注册(Product Registration):
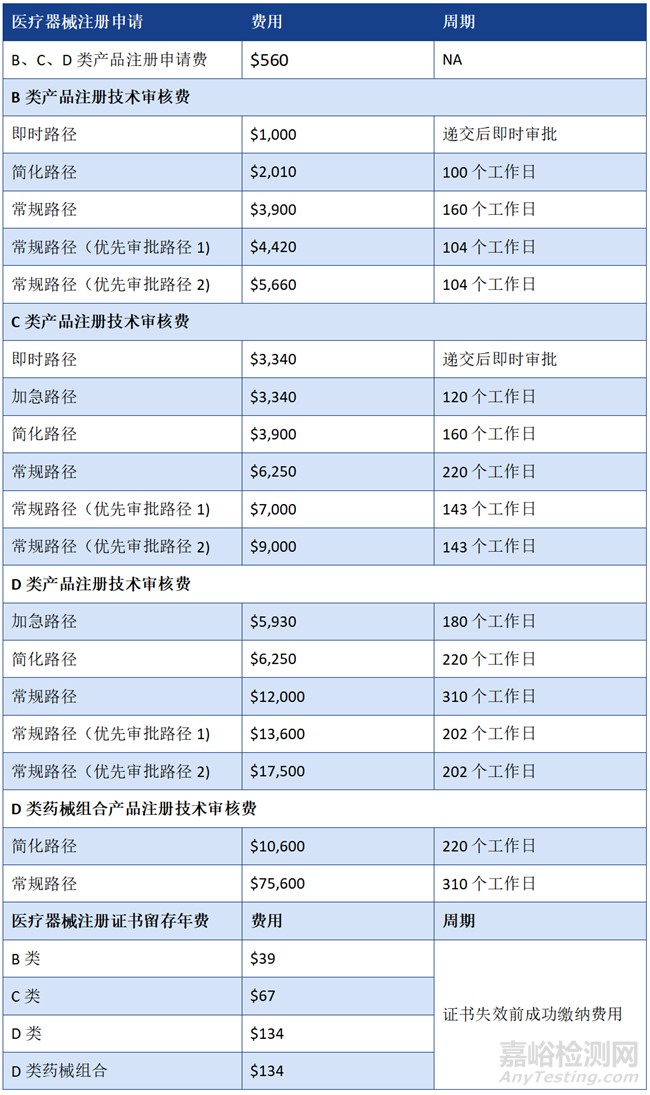
注:更多信息可见Fees and turnaround time for medical devices
4、注册提交
制造商许可和产品注册申请递交需通过MEDICS(Medical Device Information Communication System),非新加坡当地企业需授权新加坡当地企业和/或注册人进行申请递交。
5、UDI要求
HSA实施UDI要求的时间线为:2024年所有D类需赋码UDI,2026年所有C类,2028年所有B类;A类不作强制要求,制造商/进口商可自愿赋码UDI。值得一提的是,HSA无特殊UDI赋码标准要求,可与USA和/或EU同用。另外,HSA无上传UDI要求,其Singapore Medical Device Register (SMDR)数据库可以自动获取产品注册技术文档中产品标签UDI信息并发布。

来源:广东医疗器械学会


