您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-12-16 19:40
近日,英国MHRA发布了修订后的未来医疗器械监管框架路线图。这进一步更新了实施未来医疗器械法规的预定时间表。
今年1月,MHRA发布了2024年路线图,详细介绍了计划如何实施未来的医疗器械法规。现在,MHRA于12 月发布了修订版路线图。新修订的路线图提供了四个关键领域的最新信息,以及每个领域的相关里程碑和预期时间表。
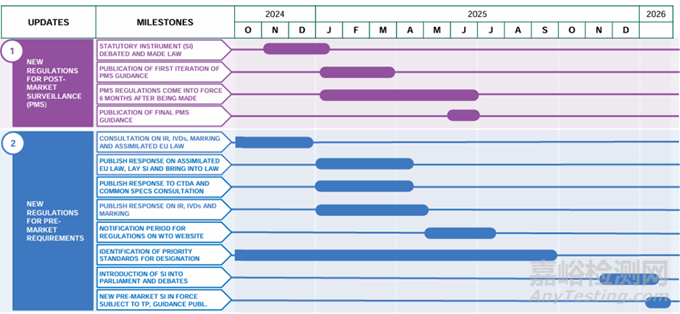

上市后监督
预计PMS指南的初稿将于2025年第一季度发布。该法规将在6个月后生效,最终版本预计在2025年年中发布。
上市前要求
MHRA在11月启动了一项咨询活动,对医疗器械在英国投放市场之前必须满足的监管要求进行改革。这项咨询活动将于2025年1月5日结束,答复将于2025年上半年公布。预计草案将于2025年年中在WTO网站上公布,而SI将于2025年年底提交议会并进行辩论,新的上市前SI将于2026年生效。
政策制定
新的EUA指南将于2025年第一季度制定和发布
目前正在制定早期使用和创新政策,计划于2025年上半年发布
HIE政策和指南将根据政府战略进行完善,并于2025年年中发布
IVD路线图预计将于2025年4月至9月间制定和发布
预期软件指导文件
预计2025年还将发布四份与软件有关的指导文件,包括人工智能 (AI) 和数字心理健康产品:
数字心理健康技术指南草案目前正在制定中,预计将于2025年第一季度发布
GMLP映射指南预计将于2025年第一季度发布,以征求意见
人工智能开发和部署指南预计将于2025年第二季度发布,以征求意见
计划于2025年第二季度发布SaMD网络安全指南

来源:Internet


