您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-16 08:56
对于细胞治疗产品来讲,成瘤性(tumorigenicity)评估是非临床研究中的重要一环。成瘤性指细胞接种动物后在注射部位和(或)转移部位由接种细胞本身形成肿瘤的可能性,即接种的细胞自身形成肿瘤的可能性。
干细胞因其潜在的增殖和分化能力,是成瘤性关注的重点药物类型。干细胞主要分为两类:多能干细胞(pluripotent stem cells, PSCs)和成体干细胞(somatic stem cells)。PSCs是在胚胎发育过程中产生的,可以分化为胚胎的内胚层、中胚层或外胚层,也就意味着能发育成机体的各种器官或组织。但PSCs仅在胚胎中存在,伦理方面的考量限制了这类干细胞的使用。2006年,Shinya Yamanaka团队对成纤维细胞进行基因改造,使其具备了分化能力,继而出现了诱导多能干细胞(induced pluripotent stem cells, iPSCs)。iPSCs目前已经能分化出100多种不同细胞。除了多能干细胞,还有一类称之为成体干细胞的存在,包括间充质干细胞(mesenchymal stem cells, MSCs)、造血干细胞(hematopoietic stem cells, HSCs)、神经干细胞、上皮干细胞、视网膜干细胞、皮肤干细胞等。不过,成体干细胞的分化能力比较弱,只能分化为特定的几种细胞,相应的成瘤性风险也较多能干细胞低。
2010年,首个人胚胎干细胞产品在美国进入临床。首个自体移植、异体移植来源于诱导的多能干细胞的视网膜色素上皮细胞分别于2014年和2017年在日本开展临床研究,用于年龄相关黄斑变性治疗。当然,现在处于临床阶段的干细胞产品就更多了,评估这些产品形成肿瘤的风险对人体来讲非常重要。
成瘤性试验传统方法是将细胞移植在免疫缺陷鼠体内,比如移植到皮下、肾包膜或睾丸包膜部位,之后监测瘤块的形成。但动物试验的灵敏度受种属、免疫缺陷程度等影响,会出现一定变异。而且,动物试验与人体的相关性也存在担忧。此外,还要考虑动物试验“3R”原则。鉴于此,体外试验的优先级逐渐提高。
考虑到成瘤性试验在细胞治疗产品开发中的重要性,多国监管机构均出台了相应指导原则对其进行约定。
EMA在“Guideline on human cell-based medicinal products (EMEA/CHMP/410869/2006)”提到,如果产品有细胞转化风险,就应开展成瘤性研究,包括增殖潜力、整合进染色体能力。在“Reflection paper on stem cell-based medicinal products (EMA/CAT/571134/2009)”中对干细胞进行了特别说明,对于多能干细胞(PSC)和成体干细胞,成瘤是其固有风险,由其内在属性决定。这类产品在培养过程中也会存在基因不稳定风险。未分化、具备增殖能力的干细胞(如诱导多能干细胞(iPSC)和胚胎干细胞(ESC)具备高成瘤风险。EMA认为iPSC和ESC的致畸胎瘤风险明显高于成体干细胞如间充质干细胞和造血干细胞等。
早在2008年,FDA针对ESC就出台过文件,对于ESC细胞治疗产品中残留的未分化ESC因其成瘤风险,应该在生产过程及批放行中进行检测。检测方法可以是流式细胞术,也可以是RT-PCR。2013年,FDA出台了“Guidance for industry: Preclinical assessment of investigational cellular and gene therapy products”,要求对细胞治疗产品的成瘤性给予特别关注。FDA承认在成瘤性方面,关于最相关动物种属或动物模型的临床预测性,在科学上尚未形成统一共识。尽管如此,动物研究是现阶段相对接近的路径,可以通过设计足够长观察周期,将细胞产品移植入临床拟用解剖部位等方式增加可预测性。
2012年,日本MHLW出台了一系列针对自体、异体的成体干细胞、诱导多能干细胞、胚胎干细胞的临床前研究指南,如下图所示。MHLW各指南中,对成瘤性研究也进行了讨论。建议申请人对干细胞的成瘤可能进行评估,如有必要,应开展合适的动物研究。

2017年,中国CDE在“细胞治疗产品研究与评价技术指导原则(试行)”提到,安全性研究根据细胞来源和制备工艺过程的特点,针对成瘤性开展相关研究。2024年1月,CDE颁布的“人源干细胞产品非临床研究技术指导原则”指出,干细胞产品、干细胞产品中残留的未分化细胞或转化细胞可能存在致癌性风险,致癌性是干细胞产品安全性评价的重点关注内容,需开展成瘤性和致瘤性试验。
各国监管机构虽然对细胞治疗产品的成瘤性风险都给予了关注,但都是笼统描述,不涉及具体的评价策略和试验内容建议。
成瘤性风险主要来源于3点,细胞治疗产品中残留的多能干细胞、细胞治疗产品的转化潜能、基因不稳定。以残留的多能干细胞为例,如果诱导的多能干细胞终产品中,依然残留有具有增殖能力的多能干细胞,即使残留量很少,也有极大风险在注射部位形成畸胎瘤或囊肿,如下图所示,需要引起充分重视。
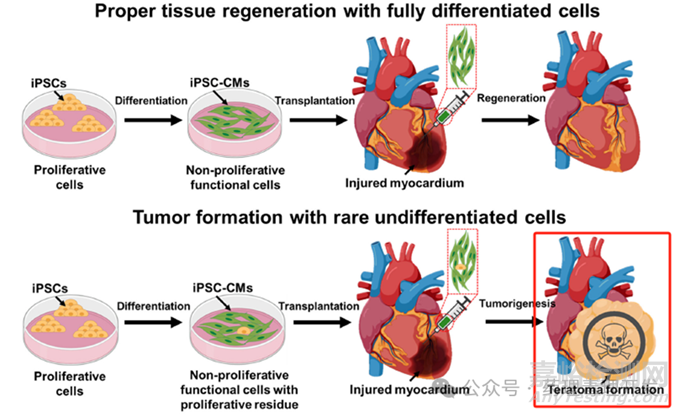
那么干细胞产品中究竟含有多少成瘤细胞才会真正成瘤呢?换言之,成瘤细胞含量的阈值是多少呢?理论上,单个的肿瘤干细胞就可以成瘤,那非肿瘤类干细胞的检测灵敏度需要达到能分辨出单一细胞吗?从现有研究报道看,目前尚未见单一干细胞,无论是处于未分化还是分化阶段,在体内成瘤的案例。通常,胚胎干细胞形成畸胎瘤的阈值细胞数量是100-10000/百万个细胞,单个胚胎干细胞或者iPSC很难存活或扩增。有人将10个胚胎干细胞接种到免疫缺陷鼠,30只动物均未见出现畸胎瘤。因此,干细胞成瘤试验的灵敏度不需要达到区分单一细胞的程度,但也要足够灵敏,比如0.001%,即100细胞/百万。
成瘤试验方法
体内方法
虽然对动物试验的转化结果存在一定争议,但目前尚无其它更有效试验方法可以替代动物。动物依然是细胞治疗产品成瘤性研究的金标准。常用于成瘤性评估的是严重免疫缺陷的动物,如T、B和NK功能缺陷的NOG、NSG小鼠。也有用免疫缺陷大鼠,大鼠的优势是可以承载更多剂量,也更容易进行复杂手术,如椎管内、心肌内给药。无论采用哪种动物模型,均需要证明细胞移植成功,并能在动物体内长期存活。大部分研究者将动物成瘤观察周期定为10-36周。FDA建议4-7个月。FDA对肿瘤生长的微环境比较关心,可能会影响细胞治疗产品的成瘤性。因此,建议动物接种细胞的位点最好与人体一致。不过,FDA未对其合理性进行详细说明。动物中的给药剂量优选人体实际用药剂量或最大可行剂量。如果药物给予特定区域如脑、脊髓、心脏或眼睛,也可以考虑根据器官重量或者靶部位体积对给药剂量进行种属间折算。动物研究流程如下图所示。

体外方法
目前已经开发出大量体外方法用于成瘤性评价,这些方法高度灵敏且特异性强,可准确估计细胞治疗终产品、中间体的成瘤情况。相关方法及优缺点如下表所示。
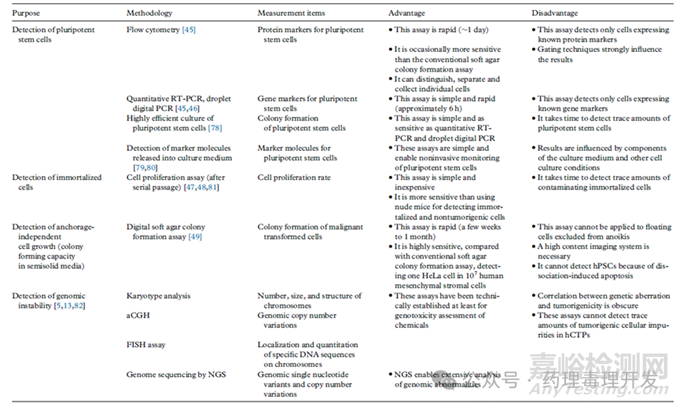
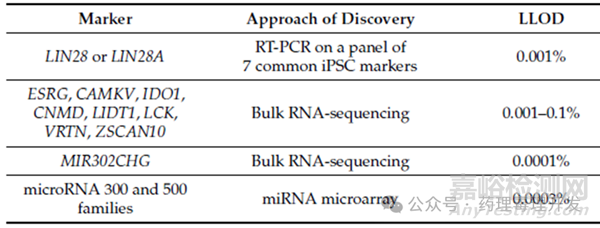
细胞治疗产品成瘤的两大风险分别是残留的未分化细胞和转化的细胞。可以基于RT-PCR、highly efficient culture方法检测残留PSCs,或者采用digital soft agar colony formation方法检测转化的细胞。PCR(RT-PCR、ddPCR)是在基因层面进行分析,比如LIN28基因作为未分化胚胎干细胞的marker之一,通过检测该基因确定残留未分化干细胞含量。但对于表达该基因的细胞如人脑细胞,就需要更换其它基因标记物,如ESRG、CAMKV、IDO1、CNMD、LIDT1、LCK等。PCR从提取RNA到出结果大概需要2-3h,比动物试验的周期短很多。下表总结了用于未分化胚胎干细胞或iPSCs检测的候选基因及可达到的检测灵敏度。
细胞法更多是在蛋白水平进行确认。通过包含不同荧光的抗体鸡尾酒,可以对多种蛋白进行标记和检测。不过,流式细胞术如果要达到0.01%灵敏度,1%变异,需要至少收集1*108个细胞,对产品和试剂的需求量很大,检测耗费时间也久。当然,目前也有些新的细胞检测技术出来,比如Stem Cell Quantitative Cytometry (SCQC)system,不再展开。
PCR也好、细胞法也罢,我们会发现都需要依赖特定基因或蛋白。通过标定潜在成瘤细胞特异性表达的基因或蛋白实现定量。不同干细胞的标记物可能不同。另外,终产物中含有该基因也不见得一定成瘤。那有没有一种更为普适的方法?
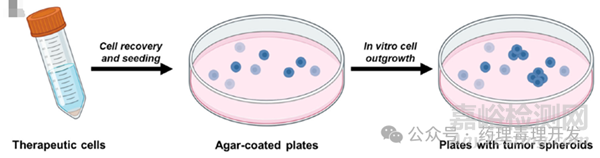
软琼脂集落形成实验(soft agar colony formation assay)可以不依赖任何标记体外检测细胞产品的成瘤性。如下图所示,将产品制备成单细胞悬液,与琼脂糖凝胶混合后接种至培养皿。成瘤细胞形成的集落更大,侵袭性更强。有团队将0.0001%的HeLa肿瘤细胞/间充质干细胞进行软琼脂实验,可以明显观察到大的集落的形成,灵敏度非常高。软琼脂实验不仅可以用于干细胞成瘤性评估,也适用于其他基因编辑细胞。当然,软琼脂实验在检测周期这块,与PCR或细胞法相比,并不讨好。以HeLa细胞为例,传统培养条件下的软琼脂实验需要30天左右,即使改进培养条件,也需要至少2周左右。因此,可先用短、平、快的PCR或细胞法进行初验证。
遗传的不稳定性是细胞治疗产品成瘤的一大风险,比如可能的基因突变、基因扩增、核型异常或染色体重排。虽然遗传不稳定与细胞类型、培养方法等因素相关,但比较建议的方案是减少培养时间、减少细胞传代,并尽可能获得遗传稳定的细胞产品。用于检测遗传稳定性的方法包括G-banded karyotyping, fluorescence、in situ hybridization (FISH)、array comparative genomic hybridization (aCGH)、single nucleotide polymorphism (SNP) array、next-generation sequencing (NGS)。但是,目前的难点是如何对这些体外试验的结果进行解释,比如出现遗传修饰的数量与实际成瘤风险相关性的建立。毕竟不是有1个突变就会导致产品成瘤。
除了以上体内和体外手段外,随着器官芯片技术的发展,将人体细胞或组织与免疫细胞共培养,建立人体模拟度更高的微环境也是一个方向,并已经取得一些进展,可以潜在更客观、真实的评价细胞治疗产品的成瘤性。

来源:药理毒理开发


