您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-30 18:20
摘 要
本文介绍了我国药品注册审评结论异议解决程序的历史沿革,现行程序的适用内容和工作流程,结合实施情况提出对我国药品注册审评结论异议解决的相关思考。现行药品注册审评结论异议解决程序与复审程序相比,切实保障了申请人的申辩权利,有效实现了技术争议前置到审评阶段解决。随着审评结论异议解决工作的开展,申请人也应进一步探索优化申报路径,尽量在更早期的申报前沟通交流阶段与审评机构就潜在的技术争议进行沟通,如pre-IND或pre-NDA会议,以进一步提高审评效率,降低研发成本。
药品注册是指药品注册申请人依照法定程序和相关要求提出药物临床试验、药品上市许可、再注册等申请以及补充申请,药品监督管理部门基于法律法规和现有科学认知进行安全性、有效性和质量可控性等审查,决定是否同意其申请的活动。药品技术审评是指药品审评机构依据现有法律法规、技术指南、科学认知等对药品注册申请人(以下简称申请人)提交的申请资料等进行全面的技术评价,并作出是否同意其申请事项的技术决定的过程。在该过程中,审评人员和申请人会对一些科学问题有所争议,有效解决此类争议是科学高效开展审评、鼓励药物研发创新的重要方面。本文的异议是指申请人对国家药品审评机构(即国家药品监督管理局药品审评中心,以下简称审评机构)作出的技术审评结论的不同意见。
为实现将异议尽早在前端解决的改革目的, 2020-09-01,国家药品监督管理部门发布《药品注册审评结论异议解决程序(试行)》,用审评结论异议解决制度代替了原有的复审制度。本文介绍了我国药品注册审评结论异议解决程序的历史沿革,现行程序的适用内容和工作流程,并结合实施情况提出了对我国异议解决程序的相关思考。
1、 早期药品注册审评结论异议解决程序
1.1 2007年至2015年实施行政审批后的复审制度
2007-10-01,国家药品监督管理机构实施《药品注册管理办法》(食品药品监管局令第28号,以下简称28号令),规定申请人对国家食品药品监督管理局作出的不予批准决定有异议的,可以在收到不予批准的通知之日起60日内,针对原申请事项及原申报资料向国家食品药品监督管理局提出复审申请并说明复审理由,国家食品药品监督管理局接到复审申请后,在50日之内作出复审决定,复审需要进行技术审查的,国家食品药品监督管理局组织有关专业技术人员按照原申请时限进行审查。28号令明确对药品注册申请审评结论有异议的申请人可在行政审批后提出复审,复审程序的技术审查环节时限与原注册申请的审评时限相同。
2009-02-27,审评机构发布《复审品种审评工作程序(试行)》,细化了需要进行技术审查的复审品种的审评工作流程,明确规定成立复审工作专项小组,以复审审评工作会议的形式讨论处理结论,必要时可聘请外部专家和复审申请人沟通交流。如处理结论为建议对原审评结论予以纠正的,品种将返回原审评部重新进行审评。组建专项工作小组和引入外部专家咨询及申请人陈述,有助于提高药品注册审评结论异议品种处理工作的质量和效率,进一步保障了审评审批工作的公开、公平、公正。
然而,结合实际运行情况,耿晓雅等研究认为上述复审程序仍存在一些问题,如申请人只能在国家局作出不予批准的行政决定后提出申请,技术争议难以在技术审评阶段得到解决,复审过程中未设置有效的沟通交流通道,也未规定外部专家咨询和申请人陈述为必要程序,实际运行中主要以内部会议形式作出复审结论,仅在极少数情况下邀请外部专家和申请人召开三方会议,未能完全保障申请人的申辩权利。
1.2 2015年至2020年实施行政审批前的复审制度
2015-11-11,国家药品监督管理部门结合复审工作中发现的问题和行业意见,对药品注册审评结论异议解决工作进行了改革,发布实施《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告(2015年第230号)》(以下简称230号公告)。230号公告要求审评机构将技术审评不予通过的审评意见告知申请人,申请人持有异议的,可提出复审申请,由审评机构组织听取审评专家和申请人的意见,公开论证,按少数服从多数的原则形成最终复审意见。此次改革调整了复审申请的提出节点和办理要求,首次提出了将审评异议解决的节点前置至行政审批前的技术审评环节,并要求将专家咨询和申请人陈述作为药品审评机构办理复审的必要程序。
2015-12-25,为贯彻落实230号公告的要求,审评机构在官网发布《关于征求<药品注册技术审评复审工作管理办法(试行)>意见的通知》,向社会公开征求意见。虽然实际运行中,审评机构启动了技术审评环节的复审工作,但该管理办法后续未正式发布。
1.3 2020年以后实施行政审批前的审评结论异议解决制度
2020-07-01,国家市场监督管理机构实施《药品注册管理办法》(国家市场监督管理总局令第27号,以下简称27号令),结合复审工作改革经验,规定对不通过的审评结论有异议的,申请人可以向审评机构提出异议申请。为落实27号令规定,同年9月1日,国家药品监督管理部门发布实施《药品注册审评结论异议解决程序(试行)》,进一步规定审评结论异议解决工作的沟通交流、申请人申辩、专家咨询委员会论证和时限的要求和工作流程。
审评结论异议解决程序的实施,为进一步提高药品注册过程中异议解决工作的质量和效率奠定了法规基础,也标志着我国现行药品注册审评结论异议解决程序基本建立,审评结论异议解决制度代替了复审制度。
2、 现行药品注册审评结论异议解决程序
2.1 适用范围
药品注册审评结论异议解决程序是药品注册申请人对审评机构作出的药品注册申请不予通过的审评结论有异议时,药审中心组织处理有关工作的程序,具体适用范围见表1。

2.2 工作程序
药品注册审评结论异议解决程序包括结论告知、异议提出、接收、综合评估、反馈、召开沟通交流会、召开专家咨询会论证、形成最终审评结论等,具体流程见图1,可分为启动、综合评估、召开沟通交流会、召开专家咨询委员会论证、形成最终审评结论几个环节。
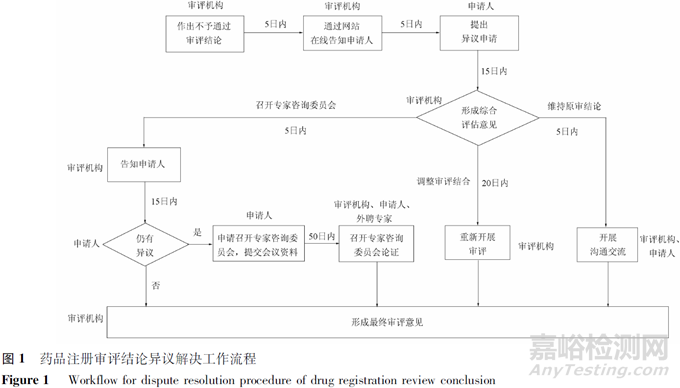
2.2.1 启动
审评机构完成综合审评作出不通过的审评结论的,在5日内通过网站定向告知申请人审评不通过的结论、理由以及申请人提起异议的权利、渠道、方式、事项和期限等。申请人收到后有异议的,在15日内可提出异议申请,说明异议的理由和依据,异议内容仅限于原申请事项和原申报资料。审评机构收到异议申请时药品注册审评结论异议解决程序启动。告知、提出和接收均通过审评机构网站线上办理,信息同步传送,申请人可在网站申请人端口在线查看办理进展。
2.2.2 综合评估
异议申请的处理一般由药品注册申请的原技术审评团队负责。审评团队在收到异议申请后的15日内作出综合评估意见,评估结论分为调整审评结论、维持原审结论、召开专家咨询委员会论证3种,具体适用范围见表2。

2.2.3 沟通交流会
对于维持原审结论且不召开专家咨询委员会论证的异议申请,审评团队应当在5日内主动与申请人进行沟通交流,告知申请人仍维持原审结论的理由,审评实践中此类沟通交流一般为电话视频会议。
2.2.4 专家咨询委员会论证
申请人提出召开专家咨询委员会论证的申请并提交会议相关资料的,审评机构在收到申请后的50日内召开专家咨询委员会进行论证。审评实践中,为保障公平、公正,异议程序中的专家咨询委员会一般由参会专家推选的专家组长主持,申请人、审评团队分别陈述理由,参会专家现场形成专家咨询委员会论证结果。
2.2.5 最终审评结论
审评团队根据综合评估结论的不同,分别结合重新开展技术审评的结果、专家咨询委员会论证结果等,形成最终审评结论。最终审评结论不再适用审评结论异议解决程序,申请人仍有异议的,在收到行政审批意见后,可按对行政许可决定有异议,依法提起行政复议或者行政诉讼。
3、 讨论
药品注册是监管部门基于对申请人申请事项和内容的安全性、有效性和质量可控性等的技术审查,再决定是否同意其申请的活动,行政审批前的技术审评是药品注册的核心评价环节,审评结论直接影响行政审批的结果,对注册申请人的利益至关重要。审评过程中,审评机构和申请人可能会对一些科学问题有所争议,如何优化此类技术争议的解决机制,对于鼓励药物的研发创新,提高药品注册的审评审批质量十分重要。
国家药品监督管理部门和审评机构通过一系列改革,将药品注册异议解决机制从行政审批后的复审转变到行政审批前的注册审评结论异议解决,有效实现了在早期解决技术争议。结合复审工作中发现的问题和行业意见,国家药品监督管理部门和审评机构在注册审评结论异议解决程序中还引入了与申请人的沟通交流机制和专家咨询委员会论证机制。审评机构通过开通线上异议资料提交通道、召开沟通交流会议、申请人现场答辩等方式充分听取申请人意见,并组织第三方专家咨询委员论证,综合专家意见进行评估,切实保障了申请人的申辩权利。
新机制运行后的实际情况显示,申请人和审评机构的异议沟通交流渠道更加畅通,通过注册审评 结论异议解决程序有效实现了技术争议在审评环节解决。注册审评结论异议解决成果提示早期沟通交流在解决审评异议中发挥重要作用,随着审评结论异议解决工作的开展,申请人可进一步探索优化药品注册申报路径,尽量在更早期的注册申报前的沟通交流阶段如临床试验申请前(pre-IND)会议或新药上市申请前(pre-NDA)会议,与审评机构就关键技术问题进行充分沟通,以降低审评过程中技术争议发生的风险,进一步提高审评效率,降低研发成本。

来源:CJCP临床药理学


