您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-31 14:48
一、基本概况
1、自然环境
英国地处西欧,由大不列颠岛(包括英格兰、苏格兰、威尔士)、爱尔兰岛东北部和一些小岛组成。隔北海、多佛尔海峡、英吉利海峡与欧洲大陆相望。海岸线总长11450公里。属海洋性温带阔叶林气候。国土面积为24.41万平方公里(包括内陆水域)。2020年1月31日,英国正式脱离欧盟。
2、人口和行政区划
英国人口为6759.6万(2022年)。官方语言为英语,威尔士北部还使用威尔士语,苏格兰西北高地及北爱尔兰部分地区仍使用盖尔语。居民多信奉基督教新教(占总人口的51%),主要分英格兰教会(亦称英国国教、圣公会)和苏格兰教会(亦称长老会)。另有天主教会及伊斯兰教、印度教、锡克教、犹太教和佛教等较大的宗教社团。
英国分为英格兰、威尔士、苏格兰和北爱尔兰四部分。英格兰划分为9个地区,下辖伦敦、56个单一管理区政府、201个非都市区和36个都市区政府。苏格兰下设32个区,威尔士下设22个区,北爱尔兰下设11个地方市郡。中央政府负责外交、国防国家安全、总体经济和货币政策、就业政策以及社会保障等,苏格兰、威尔士议会及其行政机构负责地方事务。首都为伦敦(London),人口883万(2022年)。
3、2024年出口概况
英国重视自由贸易,主要贸易对象是欧盟、美国、中国、日本。2024年1-10月,中国向英国出口医疗器械总计约98.19亿人民币,同比增加10.58% 。
二、英国医疗器械监管机构和法规要求
药品和健康产品监管机构(Medicines and Healthcare products Regulatory Agency, MHRA)负责英国的医疗器械产品注册。在英国上市的医疗器械产品,需要进行UKCA认证。注册需要遵循医疗器械法规Medical Devices Regulations 2002 (SI 2002 No 618, as amended) (UK MDR 2002)。该法规基于欧盟的医疗器械法规MDD(93/42/EEC)、AIMDD(90/385/EEC)和IVDD (98/79/EC)所制定,根据英国的情况做了适当调整。
不同类型的产品,适用于法规的不同部分:
◆ 普通医疗器械(MD): Part II of the UK MDR 2002
◆ 有源植入的医疗器械(AIMD): Part III of the UK MDR 2002
◆ 体外诊断试剂(IVD): Part IV of the UK MDR 2002
三、医疗器械定义
◆ 医疗器械指:
单独使用或组合使用的仪器、设备、器具、材料或其他物品,以及其适当应用所需的任何软件,其应:
(a) 用于人类,且制造商预期实现以下目的:
(i) 疾病的诊断、预防、监测、治疗或缓解,
(ii) 对伤害或残障的诊断、监测、治疗、减轻或补偿,
(iii) 对解剖结构或生理过程的调查、替换或修改,或
(iv) 控制受孕;及
(b) 不能通过药理学、免疫学或代谢手段实现其在人体中或对人体的主要预期目的,即使其功能得到这些手段的辅助,
此外还包括旨在管理药品的设备,或包含一种如果单独使用属于药品的物质作为其不可或缺的组成部分,且该物质可能对人体产生与设备作用相关的辅助作用的设备。
◆ 有源植入医疗器械指:
(a) 其功能依赖于电能或不是由人体或重力直接产生的能量源;以及
(b) 打算全部或部分引入人体(无论是通过外科手术还是医疗手段,包括通过天然孔道引入),并且打算在将其引入的外科或医疗程序完成后依然留在人体内,即使该器械意图是给药某种药品,或将某种如果单独使用的情况下属于药品的物质作为不可或缺的组成部分,符合上述前提的也属于有源植入医疗器械。
◆ 体外诊断医疗器械指:
(a) 试剂、试剂产品、校准品、质控品、试剂盒、仪器、器具、设备或系统,无论是单独使用还是组合使用;以及
(b) 制造商预期将其用于体外检测来自人体的标本,包括血液和组织捐赠,其唯一或主要目的是提供以下信息:
(i) 关于生理或病理状态
(ii) 关于先天异常
(iii) 确定捐献(包括血液和组织捐献)与潜在受体的安全性和兼容性,或
(iv) 监测治疗措施
此外还包括样本容器,但不包括一般实验室使用的产品,除非该产品根据其特性,由制造商特别设计用于体外诊断检查。
四、产品分类
1. 分类依据:
MD: Annex IX of Medical Device Directive 93/42/EEC
IVD: Annex II of In Vitro Diagnostic Medical Devices 98/79/EC
2. 分类
MD:I、IIa、IIb、III(I类风险最低,III类风险最高)
IVD:General IVDs、IVDs for self-testing、IVDs in List B、IVDs in List A
注:Self-testing IVD指由非专业人士在家庭环境中使用的IVD。如果一个IVD产品既是self-testing IVD,又被列于List A或List B,那么其符合性应按List A或List B级别的要求来进行评估。
目前,List A和List B 中包括以下IVD:
List A:
- 确定以下血型的试剂:ABO系统、rhesus(C、c、D、E、e)、anti-Kell系统;
- 艾滋病(含HIV 1/2)、人类T淋巴细胞病毒(含HTLV I/II)、乙型肝炎、丙型肝炎、丁型肝炎的诊断试剂;
- 用于变异型克雅氏病(vCJD)的血液筛查、诊断和确认的试剂。
List B:
- 确定以下血型的试剂:anti-Duffy和anti-Kidd 系统;
- 测定不规则抗红细胞抗体的试剂;
- 检测和定量风疹、弓形虫病感染的试剂;
- 诊断苯丙酮尿症的试剂;
- 确定巨细胞病毒、衣原体感染的试剂;
- 确定HLA组织类别(DR/A/B)的试剂;
- 确定肿瘤标志物PSA的试剂;
- 评估21三体综合征风险的试剂;
- 血糖测量装置。
五、注册流程
1、产品注册流程
根据产品类别不同,其注册流程也有不同:
◆ 对于分类为General IVD或Class I且不属于无菌或测量器械的MD, 制造商自我宣称其符合性即可。
◆ 对于分类为Class I的无菌或测量器械、IIa、IIb和III的MD,以及属于self-testing、List A或List B的IVD, 其注册需要认证机构Approved Body(AB)的参与,制造商选择有资质的AB并与其签约后,AB会根据制造商所选的符合性路径对产品进行审核,通过即可获得UKCA证书。
◆ 无论是什么类别的产品,制造商在获得UKCA证书,或自我宣传符合后,都要向MHRA进行产品注册,才能正式将其投入英国市场。这一步骤只能由英国的企业完成,所有英国外的企业指定有资质的英国负责人来代其完成这一步骤。英国负责人同时还承担英国授权代表的职责。
2、注册提交技术文件(TD)

3、注册周期及费用
AB的审核周期及费用由每个AB自行报价。
MHRA注册的费用为240英镑/申请。每个申请最多可以注册100个品类(归于同一个GMDN code的器械被视为一个品类),而这100个品类一共可包含20,000个产品/型号(每个产品应有唯一的品牌、商用/专有名称、型号、版本、识别号、UDI-DI)。
对已有注册进行修改被视为进行新的注册,因此需重新支付240英镑。
4、注册提交流程
如UKCA认证需要AB介入,制造商自行与AB联系,签订合同即可。
MHRA上的注册在DORS(Device Online Registration System)上进行,英国境外的制造商只能通过英国负责人完成,不可以自己提交。
只有获得MHRA的确认信,MHRA上的注册才能被视为成功。
5、现场审核要求及注意事项
有AB介入的UKCA认证,需要进行现场审核。英国对质量管理体系的要求基本遵循ISO 13485的框架,自己的QMS要求主要集中在警戒系统(有自己的不良事件上报方式和数据库)、标签说明书(UKCA标识的使用)和英国负责人的职责上。
7、该区域有关UDI的要求
在MHRA注册时,自愿使用UDI,不强制要求(但未来法规更新应该会转为强制)。
其他注意事项或特别提醒
1、关于有CE标识的产品在英国的上市过渡期和具体要求:
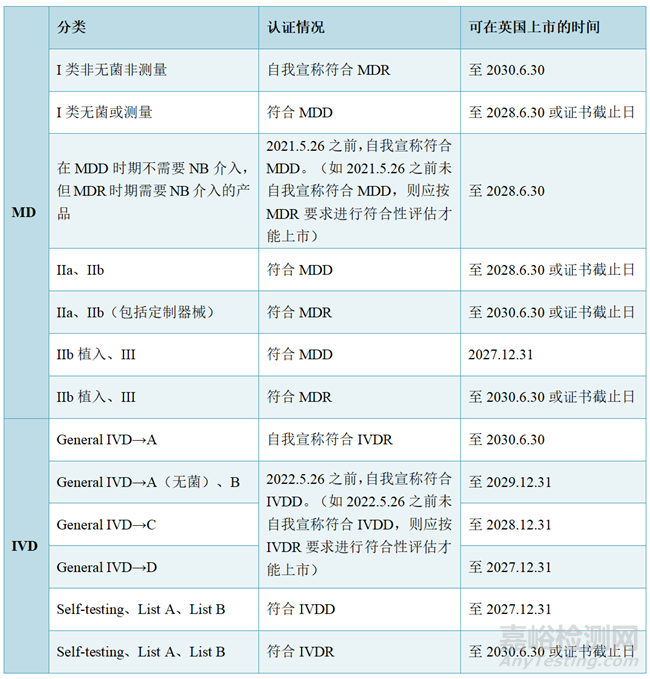
2、北爱尔兰医疗器械的上市要求:
自2021年5月26日起,欧盟MDR在北爱尔兰适用。自2022年5月27日起,欧盟IVDR在北爱尔兰适用,因此在北爱尔兰上市的医疗器械需要进行CE认证,而不需要进行UKCA认证。
此外,如果该产品的CE证书是由英国的公告机构发放的,该产品还需要有UKNI标识。UKNI标识只适用于英国公告机构作为发证机构,根据MDR或IVDR对产品进行符合性评估,并颁发CE证书的情况(而不是UKCA证书)。目前,还没有英国的机构获得从事这类审核的资质,如果将来有,那么获证的产品需要同时标记UKNI和CE标识,而不能仅标记CE标识,且UKNI+CE的组合标识的产品,不能在欧盟进行销售。反之,如果CE证书是由欧盟的公告机构发放的,产品独立标记CE标识,那么可以在北爱尔兰进行销售。此外,UKNI+CE的产品,可以在英国市场销售。
另外,需要注意的一点是,英国境外的制造商的产品在北爱尔兰销售不需要英国负责人进行代理,但需要北爱尔兰代理或欧代。

来源:广东省医疗器械管理学会


