您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-11 09:01
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
勃林格殷格翰尼达尼布获FDA批准新适应症。勃林格殷格翰(BI)小分子酪氨酸激酶抑制剂Ofev(ninetdanib)获FDA批准,治疗慢性进行性纤维化间质性肺病(ILDs)患者。这是Ofev获FDA批准的第三项适应症,也是FDA批准治疗ILDs的首款疗法。在一项Ⅲ期临床INBUILD中,Ofev将患者的肺功能下降幅度减少了57%,而且安全性和耐受性与之前在特发性肺纤维化(IPF)研究中观察到的结果一致。研究数据已发表在《新英格兰医学杂志》(NEJM)上。
1.武田维多珠单抗即将获批。近日武田新型抗炎药注射用维多珠单抗的上市申请审评状态变更为「在审批」,预计即将获批上市。此次申报的适应症是溃疡性结肠炎(UC)和克罗恩病(CD)。维多珠单抗(vedolizumab,Entyvio)是由武田研发的一款人源化单抗药物,其静脉注射剂型已在全球60多个国家和地区获批,用于治疗对传统疗法或者对TNFα拮抗剂治疗缓解不充分、不再得到缓解或不耐受的中重度UC和CD患者。
2.辉瑞伊珠单抗奥唑米星拟纳入优先审评。辉瑞注射用伊珠单抗奥唑米星被纳入拟优先审评公示名单,该新药申报的适应症是复发/难治性CD22阳性的急性淋巴细胞白血病(ALL)。伊珠单抗奥唑米星是由辉瑞和优时比联合开发的一款抗体偶联药物(ADC),于2017年8月获FDA批准用于治疗复发或难治性前体B细胞ALL患者,商品名为Besponsa。Besponsa也是FDA批准的首款靶向CD22的ADC。
3.亚盛医药Bcl-2抑制剂在中美获多项临床许可。亚盛医药在研1类新药Bcl-2抑制剂APG-2575日前接连获得FDA两项临床试验许可,将分别开展作为单药或联合治疗复发/难治慢性淋巴细胞白血病 ( r/r CLL) /小淋巴细胞淋巴瘤 (r/r SLL) 的Ib/ II期研究;作为单药或联合治疗华氏巨球蛋白血症 (WM) 的Ib /II期研究。此外,APG-2575日前还在中国获得国家药监的批准,将开展单药或联合治疗复发/难治性急性髓系白血病 ( r/r AML) 的Ib期研究。
4.安进KRAS G12C抑制剂在中国申报临床。安进口服选择性KRAS G12C抑制剂AMG 510的临床申请获CDE受理。一项在ESMO2019大会上公布的I期临床结果显示:在12例接受AMG 510(960 mg/日)治疗的结直肠癌患者中,1例患者达到部分患者,10例达到疾病稳定,疾病控制率达到92%;在13例接受AMG510(960 mg/日)治疗的非小细胞癌患者中,7例患者达到部分缓解,6例患者达到疾病稳定,疾病控制率为100%;在2例阑尾癌患者中,1例达到部分缓解,1例达到疾病稳定。
5.恒瑞新型口服抗真菌药申报临床。恒瑞1类新药SHR8008胶囊的临床申请获得CDE受理。SHR8008(VT-1161)是由Mycovia公司研发的新型口服小分子选择性真菌 CYP51抑制剂,对真菌CYP51的选择性显著优于现有常用唑类抗真菌药。恒瑞医药拥有SHR8008在中国的临床开发、注册、生产和市场销售的独家权利,许可的适应症为所有人类和动物疾病和症状的治疗和预防,包括但不限于复发性外阴阴道念珠菌病、甲真菌病和侵袭性真菌感染。
6.基石药业A2aR拮抗剂CS3005申报临床。基石药业1类新药CS3005片临床申请获国家药监局受理。CS3005是基石药业开发的一种A2aR拮抗剂,正在澳大利亚开展用于晚期实体瘤患者的I期临床研究(NCT04233060)。目前,对A2aR拮抗剂的开发于全球范围内均处于初步阶段。包括CS3005在内,全球范围内临床进展较为超前的A2aR拮抗剂有AZD4635(阿斯利康)、CPI-444(Corvus/罗氏)、AB928(Arcus/罗氏)、PBF-509(诺华)、SHR5126片(恒瑞)等。
1.赛诺菲/再生元Dupixent用于严重哮喘遭NICE拒绝。英国国家卫生与临床优化研究所(NICE)宣布不推荐赛诺菲/再生元的Dupixent用于治疗严重哮喘。NICE认为,Dupixent与市场上其他哮喘可用药物(包括葛兰素史克Nucala、梯瓦Cinqair和阿斯利康Fasenra)缺乏头对头的对比试验数据,并称该药不符合成本收益标准。Dupixent是靶向IL-4受体α的抗体药物,2017年3月获FDA批准,成为首个治疗中重度特应性皮炎的生物制剂。2018年10月,FDA批准Dupixent用作附加维持疗法,治疗≥12岁的中重度哮喘患者,包括嗜酸性表型哮喘及口服皮质类固醇依赖性哮喘。
2.吉利德发布Biktarvy多项最新数据。吉利德在CROI 2020会议上公布其三合一复方新药Biktarvy的三项最新临床数据。在黑人和非裔美国成人HIV-1感染者中开展的III期BRAAVE 2020研究中,从多种方案切换至Biktarvy治疗的患者(包括NRTI耐药的患者),显示出非劣效性抗病毒疗效。治疗第24周,接受Biktarvy治疗的患者中有96.3%维持病毒学抑制,维持基线方案的患者中有94.5%维持病毒学抑制,没有检测到治疗中出现的耐药性。在一线治疗≥50岁初治感染者的2项III期研究(1489和1490)中,治疗144周期间,Biktarvy耐受性良好,在骨密度或肾安全性、空腹血脂或体重增加方面与基线水平无临床显著差异。
3.干眼症创新疗法达到Ⅲ期临床终点。Kala公司新型盐酸柏非特诺(loteprednol etabonate)纳米颗粒制剂Eysuvis(KPI-121)在治疗干眼症患者的Ⅲ期试验STRIDE 3中获积极结果。在使用Eysuvis治疗15天后,意向治疗组患者和严重眼部不适患者的眼部不适严重程度(ODS)达到了统计学意义的显著改善。此外,患者还达到了缓解结膜充血的关键性次要终点。该公司拟在今年第二季度重新递交Eysuvis的新药申请,预计年底前得到FDA的回复。
4.ViiV长效HIV组合疗法达到Ⅲ期临床终点。ViiV公司长效创新HIV双药组合疗法在Ⅲ期试验ATLAS-2M中达主要终点。这一组合疗法由ViiV公司在研整合酶抑制剂(INI)cabotegravir和杨森已获批上市的NNRTI抑制剂rilpivirine构成。试验结果表明,治疗48周后,每8周注射一次这一双药组合疗法,与每4周注射一次的治疗方案相比,在HIV-1感染成人患者中,达到抑制病毒的非劣效性标准。详细数据将在未来的医学会议上公布。
5.BMS免疫调节性抗体Empliciti骨髓瘤III期临床失败。百时美施贵宣布,其免疫调节性抗体Empliciti(elotuzumab)联合Revlimid(来那度胺)和低剂量地塞米松的三药方案(ERd),在治疗多发性骨髓瘤的III期ELOQUENT-1试验中未达到主要终点。与来那度胺+低剂量地塞米松二药方案(Rd)相比, ERd方案并没有使无进展生存期显示出统计学意义的显著改善。该研究中,ERd方案的安全性与Empliciti+Revlimid和地塞米松已知的安全性基本一致。Empliciti由BMS和艾伯维共同开发,是多发性骨髓瘤(MM)的首个免疫抗体疗法。
1.美国境内新冠肺炎确诊病例累计超过700例。据美国有线电视新闻网报道,截止到美东3月9日19点,全美已经有36个州和华盛顿特区出现新冠肺炎确诊病例,累计确诊病例至少达到704例,26人死亡。确诊病例数包括从武汉撤侨回美国的3人、从“钻石公主”号邮轮撤侨回国的46人、以及“至尊公主”号邮轮上被确诊的21人。目前,全美已经有10个州宣布进入紧急状态。
2.武汉连续两日新增确诊病例50例以下。3月9日,国家卫健委新闻发言人米锋在国务院联防联控机制新闻发布会上表示,湖北以外省份本地新增确诊病例数自2月27日以来均在个位数,3月7日~8日连续2日无本土新增确诊病例;湖北除武汉以外所有地市连续4日无新增确诊病例;武汉连续2日新增确诊病例降至50例以下。下一步,要紧紧抓住严格防控和医疗救治两个重点,防止疫情反弹。
3.广东要求建立医院感控督导员制度。广东省近日要求二级以上医院(含二级)建立感控督导员队伍,完善运行机制,精准、实时监测和指导隔离病区等高风险区域工作人员防护工作,避免发生职业暴露,督导医疗机构各病区(房)、科室做好感染防控工作,最大限度确保医护人员与患者的健康和生命安全。据了解,感控督导员是指经过相关培训、参与医疗机构感染防控的监督与管理工作的医务人员。。
【以岭药业】全资子公司以岭万洲制剂产品塞来昔布胶囊获得美国FDA批准文号,其可抗炎症、镇痛,美国市场的2018年度销售额约为18931万美元。
【鲁抗医药】控股股东山东省国资委将其持有的本公司18590万股A股无偿划转给华鲁集团完成后,华鲁集团直接持有本公司18590万股,占总股本21.12%,为公司直接控股股东,山东省国资委不再持有本公司股份,但仍为公司实际控制人。
【安图生物】取得不动产权证书,该宗地的国有建设用地使用权出让价款为4233万元。
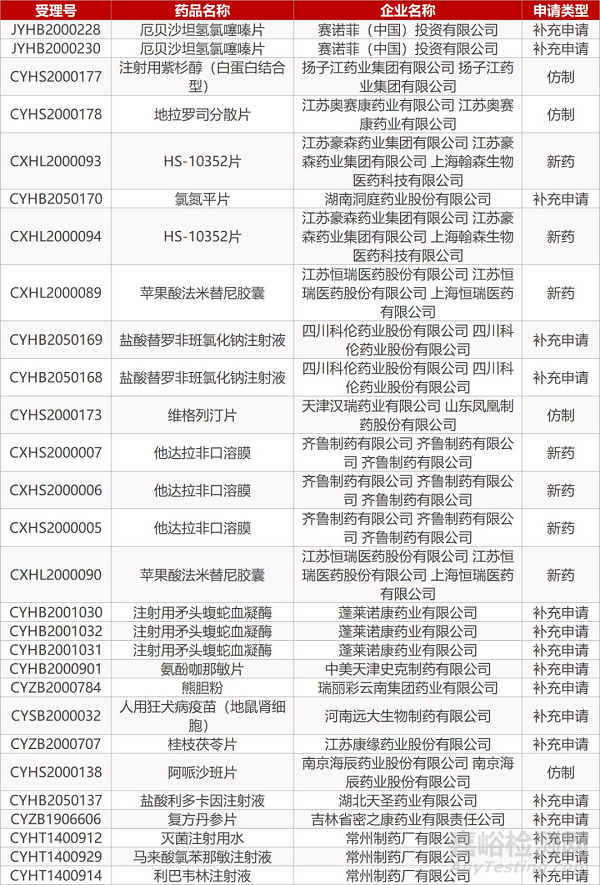
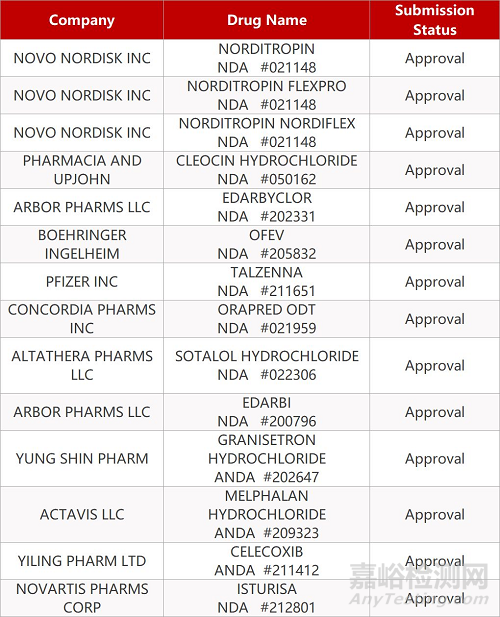
2. FDA最新获批情况(北美3月8日)
- The End -

来源:药研发


