您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-06-18 10:05
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
中国生物新冠灭活疫苗Ⅰ/Ⅱ期临床研究揭盲。6月16日,国药中国生物武汉生物制品研究所研制的新冠病毒灭活疫苗Ⅰ/Ⅱ期临床试验结果积极。该研究评价新冠灭活疫苗在18-59岁健康受试者中,按照低、中、高剂量和0,14、0,21、0,28不同程序组接种后的安全性和免疫原性。截至目前,共1120名受试者全部完成2针次接种。疫苗接种后安全、有效,接种疫苗组受试者无严重不良反应,均可产生高滴度抗体,按照0,14天和0,21天程序接种两剂后中和抗体阳转率达97.6%,按照0,28天程序接种两剂中和抗体阳转率达100%。
国内药讯
1.杭康药业帕瑞昔布钠获批上市。杭康药业4类仿制药注射用帕瑞昔布钠获国家药监局批准,视同通过一致性评价,为继百裕制药后国内第2家该产品通过一致性评价的企业。帕瑞昔布是一种COX-2)抑制剂,主要用于术后疼痛的治疗,是临床多模式镇痛的基础用药之一。原研产品由辉瑞和法玛西亚联合开发,2002年在欧洲首次上市,商品名为Dynastat。该原研药已于2008年获批进口中国,商品名为特耐。该品种获批的国内生产厂家包括科伦药业、齐鲁制药等18家。
2.Keytruda即将在华获批第5个适应症。默沙东在中国提交的帕博利珠单抗注射液(Keytruda)第5个适应症申请状态变为“在审批”,预计近期即将获批。据了解,Keytruda此次获批的适应症为二线治疗食管癌。帕博利珠单抗于2018年7月在中国首次获批,上市一年销售额便达到20亿元。目前,Keytruda已在中国获批4项适应症,除即将获批的食管癌适应症外,还有一项适应症尚处于审评审批阶段。据悉帕博利珠单抗在中国登记的III期临床试验多达20项,适应症涉及子宫内膜癌、肝细胞癌、胆道癌和尿路上皮癌等。
3.乐普生物PD-1启动晚期胃癌III期临床。乐普生物控股子公司翰中药业在研PD-1(HX008)启动一项III期临床。该研究拟入组390例晚期胃或胃食管交界处癌患者,比较HX008联合伊立替康与安慰剂联合伊立替康二线治疗PD-L1阳性(CPS≥1)患者亚组和总患者群的效果。Insight数据库显示,目前HX008在国内开展的临床共有7项,其中晚期黑色素瘤和微卫星高度不稳定(MSI-H)或基因错配修复缺陷型(dMMR)晚期实体瘤为关键性II期临床注册研究,该适应症上市申请预计于2020年第三季度提交。
4.沙东生物多发性骨髓瘤III期临床成功。沙东生物重组变构人肿瘤坏死因子相关凋亡诱导配体(CPT)治疗多发性骨髓瘤的III期临床(CPT-MM301项目)结果积极。患者接受CPT联合沙利度胺和地塞米松方案(TD方案),或安慰剂联合TD方案的治疗。结果显示,CPT联合治疗组PFS中位数比对照组显著延长约77%,疾病进展或死亡的风险降低约38%,具统计学意义(5.5个月vs3.1个月,HR=0.619,P<0.0001),符合方案集结果与此一致。CPT治疗骨髓瘤的耐受性良好,两组不良事件等总体发生率相似。
5.亚盛医药APG-1387 II期临床首例患者给药。亚盛医药在研1类新药IAP抑制剂APG-1387联合恩替卡韦治疗慢性乙型肝炎(CHB)的II期临床在中国完成首例患者给药。该项研究为一项国际多中心、开放性的Ⅱ期临床研究,旨在评估APG-1387联合恩替卡韦用于初治或经治慢性乙型肝炎患者的疗效和安全性,并计划全球多国共入组104例患者。APG-1387是中国首个进入临床阶段的IAP抑制剂。
国际药讯
1.FDA批准转移性小细胞肺癌新药。FDA加速批准Jazz制药与PharmaMar联合开发的海鞘素衍生物Zepzelca(lurbinectedin) 上市,用于治疗铂类药物化疗后疾病进展的转移性小细胞肺癌。此次批准是基于一项lurbinectedin单药治疗105例铂类药物化疗后疾病进展的铂敏感和铂耐药成人患者的开放标签、多中心、单臂研究的客观应答率(ORR)和应答持续期(DoR)数据。结果显示,研究者评估的ORR为35%,DoR为5.3个月;IRC评估的ORR为30%,DoR为5.1个月。绿叶制药拥有该新药的中国权益。
2.Keytruda第二项“不限癌种”适应症FDA获批。FDA加速批准默沙东重磅PD-1抑制剂Keytruda扩展适应症。用于单药治疗肿瘤突变负荷高(TMB-H≥10)且既往治疗后疾病进展的无法切除或转移性实体瘤患者,无需考虑癌症类型。这是TMB-H首次获FDA批准成为指导患者治疗选择的生物标志物。在一项名为KEYNOTE-158的试验中,不同类型的经治转移性实体瘤患者接受Keytruda单药治疗,TMB-H患者的总缓解率(ORR)达到30.3%,包括4%完全缓解和26.3%部分缓解;而非TMB-H患者中ORR为6.7%。两组患者无进展生存率分别为26.4%和14.1%。
3.地塞米松治疗COVID-19获英国NHS系统批准。英国政府批准英国NHS系统下医院使用地塞米松治疗COVID-19严重患者。在一项评估一系列潜在疗法(包括低剂量地塞米松)与常规疗法相比治疗COVID-19的临床试验RECOVERY中,常规治疗组中28天死亡率在需要接受机械通气的患者中最高(41%),在仅需要吸氧的患者中居中(25%),在不需要任何呼吸干预的患者中最低(13%)。地塞米松使机械通气患者的死亡率降低了1/3(0.65 [95% CI:0.48-0.88];p=0.0003),使其他单纯吸氧患者的死亡率降低了1/5(0.80 [95% CI:0.67-0.96];p=0.0021)。不需要呼吸支持的患者没有获益(1.22 [95% CI:0.86-1.75];p=0.14)。
4.礼来Olumiant治疗COVID-19 III期试验启动。礼来(Eli Lilly)类风湿性关节炎治疗药物baricitinib(Olumiant,口服JAK1/JAK2抑制剂)治疗COVID-19 III期试验首例患者入组。该研究拟入组400例至少有一个炎症标记物升高、不需要有创机械通气的COVID-19成人患者。主要终点是:与安慰剂(联合基础治疗)患者相比,接受每天服用4mg baricitinib(联合基础治疗)的患者,在28天期间死亡或需要无创通气/高流量氧或有创机械通气的患者比例。关键次要终点包括在不同时间点有临床改善的患者比例、恢复时间、住院时间、无呼吸机天数和28天内的死亡率。
5.泛PPAR激动剂NASH IIb期临床达双重终点。Inventiva公司PPAR激动剂lanifibranor治疗非酒精性脂肪性肝炎(NASH)IIb期NATIVE研究结果积极。与安慰剂相比,lanifibranor 1200mg/天剂量组患者24周SAF活动度评分(合并肝细胞炎症和膨胀)相对基线降低≥2分且纤维化无恶化的患者比例更高(49%vs27%,p=0.004),达到主要终点;此外,也达到了多个关键次要终点,包括NASH消失且纤维化无恶化、肝脏纤维化改善且NASH无恶化;lanifibranor总体耐受性良好,与先前临床试验的观察结果一致。
6.礼来2型糖尿病治疗药物Trulicity疗效优越。礼来在ADA 2020会议上公布了一项最新真实世界研究数据。在新接受GLP-1受体激动剂(RA)治疗的2型糖尿病患者中,与每周注射一次semaglutide(索马鲁肽)或exenatide(艾塞那肽)相比,Trulicity(度拉鲁肽)具有显著更高的依从性和更长的持久性。此外,与semaglutide或exenatide相比,停止Trulicity治疗的患者显著更少。Trulicity(度拉鲁肽)是一种GLP-1受体激动剂(RA),每周注射一次,该药已被批准,结合饮食控制及锻炼,用于2型糖尿病成人患者改善血糖控制。
医药热点
1.人均基本公卫经费补助再增5元。6月16日,国家卫健委、财政部、中医药管理局联合印发《关于做好2020年基本公共卫生服务项目工作的通知》。通知明确,2020年人均基本公共卫生服务经费补助标准为74元,新增5元经费全部落实到乡村和城市社区,统筹用于社区卫生服务中心(站)、乡镇卫生院和村卫生室等基层医疗卫生机构开展新冠肺炎疫情防控的人员经费、公用经费等支出,强化基层卫生防疫。
2.武汉对9056个环境样本进行采样检测。6月16日,武汉市、区疾控中心对武汉市40家农贸市场、32家超市的畜禽类、淡水产品和海鲜产品摊位的案板、刀具、容器、排水沟及其它样本共2878个进行采样检测,所有新冠病毒核酸检测结果均为阴性。自6月13日以来,武汉市已持续开展超市和农贸市场环境采样检测工作,累计抽样检测107家超市、114家农贸市场和5家水产品进出口贸易公司的环境样本9056个。专家提醒市民在农贸市场等疫情防控重点区域要做好防疫工作。
3.北京市:疫情目前还处于上升期。6月17日,北京市人民政府新闻办公室召开第123场疫情防控新闻发布会,介绍新冠肺炎疫情防控情况并回答记者提问。北京市疾控中心副主任庞星火在发布会上介绍,初步推断,本次疫情由人际传播或物品环境污染引发的感染所致。目前病例中以普通型和轻型病例为主,占总病例数的95%。由于疫情在早期即被发现,北京市疫情还处于上升期,未来发病人数还会维持并持续一定时间。
股市资讯
【恒康医疗】公司于近日收到北京东城区法院送达的应诉通知书、民事起诉状等法律文书,获悉中国民生信托因合同纠纷将本公司诉至东城区法院。
审评动向
1. CDE最新受理情况(06月17日)
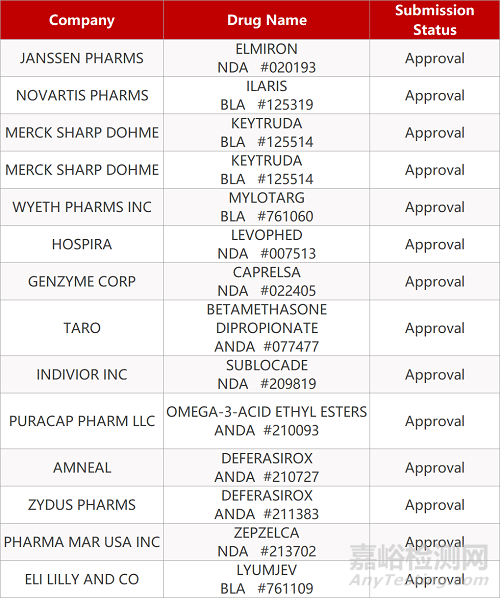
2. FDA最新获批情况(北美06月16日)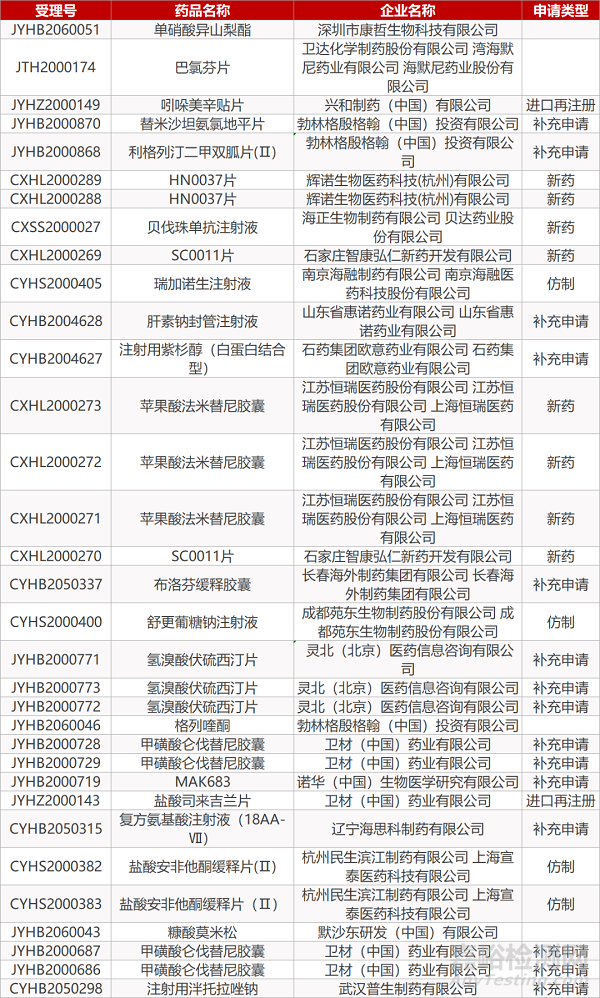
- The End -

来源:药研发


