您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-08-17 08:59
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国药中生新冠疫苗Ⅰ/Ⅱ期临床结果发表。《美国医学会杂志》刊登了国药中国生物武汉生物制品研究所和中国科学院武汉病毒研究所联合研制的新冠灭活疫苗Ⅰ/Ⅱ期临床试验结果。Ⅰ期临床中,96名志愿者于0/28/56天三次接种低、中、高剂量疫苗或铝佐剂;Ⅱ期临床中,224名志愿者于0/14和0/21天接受两次中剂量接种。疫苗诱导的中和抗体滴度结果显示,Ⅰ期临床低、中、高剂量的疫苗诱导产生的血清中和抗体几何平均滴度分别为316,206和297;Ⅱ期临床0/14和0/21疫苗组这一数值分别为121和247。研究中,疫苗组和安慰剂组的不良反应发生率相似。
国内药讯
1.复宏汉霖曲妥珠单抗获批上市。8月14 日,复宏汉霖曲妥珠单抗生物类似药获批上市,成为首个国产曲妥珠单抗生物类似药。曲妥珠单抗的原研药是罗氏的赫赛汀,是一种HER-2靶向单抗,已在国内获批多个适应症,包括 HER2 阳性的转移性乳腺癌,HER2 阳性的早期乳腺癌的辅助、新辅助治疗,HER2 阳性晚期胃癌以及超适应用药于 HER2 阳性非小细胞肺癌。该品种为罗氏旗下王牌药品,2019 年全球销售额近60亿瑞士法郎;中国城市公立医疗机构的销售额约52亿元。
2.信立泰盐酸帕罗西汀肠溶缓释片首仿获批。8月13日,信立泰4类仿制药盐酸帕罗西汀肠溶缓释片获国家药监局批准上市,成为该品种肠溶缓释剂型国内首仿。盐酸帕罗西汀是一种5- 羟色胺再摄取抑制剂,用于强迫症、广泛性焦虑症和社交恐惧症等各类型抑郁疾病。原研产品由葛兰素史克开发,目前已获批的剂型包括普通片剂和肠溶缓释片,其2019年全球销售额为2.05亿美元。除葛兰素史克外,该品种国内获批的厂家还有华海、北京福元、尖峰药业。
3.亚宝药业硫辛酸注射液首家通过一致性评价。亚宝药业4类仿制药硫辛酸注射液获国家药监局批准上市,成为该品种国内首家通过一致性评价的产品。硫辛酸注射液适用于糖尿病周围病变引起的感觉异常,原研厂家为德国史达德大药厂。2019年5月,亚宝药业分别按新4类提交了硫辛酸注射液(12ml)上市申请以及6ml规格(商品名:亚宝力舒)的一致性评价申请,但后者未获得批准。国内正在申请/视同申请该品种一致性评价的厂家还有倍特药业、天方药业等7家。
4.康方生物PD-1/CTLA-4双抗获FDA快速通道资格。康方生物PD-1/CTLA-4双特异性抗体AK104获FDA授予快速通道资格。这是继AK104单药针对二线治疗复发/转移性宫颈癌的注册临床研究获得FDA的批准后的又一重大进展。AK104是康方生物自主研发的新型的、潜在下一代首创PD-1/CTLA-4双特异性肿瘤免疫治疗骨干药物,目前在澳洲和中国开展的临床试验中已显示临床疗效和良好安全性;在中国及全球开展的多项Ⅱ期注册性临床涉及的适应症包括胃癌、宫颈癌、非小细胞肺癌、肝细胞癌、MSI-H实体瘤等。
5.赫普化医药NASH新药在中国获批临床。赫普化医药1类创新药HPN-01肠溶胶囊获国家药监局临床试验默示许可,适应症为非酒精性脂肪性肝炎(NASH)。HPN-01是一款“first-in-class”候选药物,拟用于治疗非酒精性脂肪性肝病、NASH及伴随肝纤维化。HPN-01可以调控、阻断NASH发生、发展的多条重要通路,既有效逆转肝脏脂肪变,又可以缓解肝脏内炎性反应和脂质过氧化,从而改善肝纤维化和肝功能不全。该药今年2月已在美国获批临床。
国际药讯
1.罗氏IL-6受体抑制剂获FDA批准上市。FDA批准罗氏(Roche)旗下基因泰克公司IL-6单抗Enspryng(satralizumab-mwge)上市,作为首个和唯一一个皮下治疗AQP4抗体阳性的视神经脊髓炎谱系障碍成人患者的药物。在两项Ⅲ期临床(SAkuraStar和SAkuraSky)研究中,Enspryng单药治疗以及与基线免疫抑制剂治疗(IST)联用时,与安慰剂相比均显著降低了复发风险。Enspryng单药组96周时无复发的患者比例为76.5%(vs41.1%),Enspryng+IST联合组这一比例为91.1%(vs56.8%)。今年6月,Enspryng已在日本首次获批上市;Enspryng在中国也已被纳入拟优先申请审评名单。
2.创新干细胞疗法获FDA咨询委员会推荐批准。Mesoblast公司宣布其间充质干细胞疗法Ryoncil(remestemcel-L)获FDA肿瘤药物咨询委员会推荐批准,用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿科患者。在一项Ⅲ期试验中,Ryoncil的客观缓解率达69%,与45%历史控制率相比,具统计学意义的显著增加;Ryoncil组患者的死亡率为22%,而接受初始类固醇治疗无效的患者这一数值高达70%。目前,Ryoncil的生物制品许可申请已获FDA优先审评资格,有望在9月30日之前获得回复。
3.创新口服淋巴瘤疗法获FDA优先审评资格。FDA受理TG Therapeutics公司口服PI3Kδ/CK1-ε双重抑制剂umbralisib的新药申请,用于治疗至少接受过一种抗CD20的治疗方案治疗的边缘区淋巴瘤(MZL)患者,和经治滤泡性淋巴瘤(FL)患者。FDA同时授予umbralisib用于MZL适应症的优先审评资格,预计明年2月5日之前获得答复。在一项umbralisib治疗复发/难治性MZL或FL患者的Ⅱb期临床UNITY-NHL中,每个队列均达到了总缓解率(40%-50%)的主要终点,并且这一表现得到独立审查委员会(IRC)的证实。
4.实验性SMA疗法获FDA罕见儿科疾病资格认定。FDA授予Scholar Rock公司局部肌生成抑制素激活抑制剂SRK-015罕见儿科疾病资格认定,用于治疗脊髓性肌萎缩症(SMA)。目前SRK-015正在Ⅱ期概念验证试验TOPAZ中评估单药或与SMN上调调节因子联合治疗的效果,主要终点将通过在SMA治疗中已验证有临床意义的结果指标来测量患者的运动功能,如非活动性SMA的Hammersmith功能性运动量表和改良Hammersmith量表。预计2020年第四季度报告TOPAZ的6个月中期分析数据,2021年上半年报告12个月的顶线数据。
5.遗传性溶酶体疾病基因疗法临床遭FDA搁置。Passage Bio在研GM1神经节苷脂贮积症基因疗法PBGM01的I/II期临床试验遭到了FDA的临床搁置,研究或将推迟至今年底左右开始,目的是为了进一步评估该疗法递送方法的相关风险。Passage Bio公司目前正在优先开发PBGM01,通过小脑延髓池内(ICM)注射单剂量PBGM01治疗婴儿GM1神经节苷脂贮积症,这是由β-gal缺乏而引起的一种遗传性溶酶体疾病。PBGM01利用下一代AAVhu68病毒载体将编码β-gal的改良DNA编码序列递送至细胞内,使用这种载体和给药途径的目的是提高CNS和外周神经系统(PNS)中的β-gal水平。
6.赛默飞世尔收购Qiagen失败。赛默飞世尔日前宣布,收购Qiagen的提议已经失效。此前,赛默飞世尔称与Qiagen达成有条件的收购协议,以扩展双方在专业诊断领域的产品组合,加速开发特异性更高、更快速、更全面的检测手段。由于赞成Qiagen出售的股份仅有47.02%,未满足达成收购的最低接受门槛条件,赛默飞世尔只能终止与Qiagen的收购协议,Qiagen将根据收购协议的条款向前者支付9,500万美元现金补偿。
医药热点
1.湖南为现场救护单独立法。湖南省第十三届人大常委会第十九次会议审议通过《湖南省现场救护条例》,将于2020年11月1日起施行。该《条例》明确,因自愿实施紧急救助行为造成受助人损害的,救助人不承担民事责任;救助人因现场救护产生的交通费、误工费和其他财产损失由保险公司依合同理赔或者由侵权责任人依法赔偿,受助人可以给予适当补偿。湖南省卫健部门将会同省红十字会组织编写现场救护基本知识与技能培训教材,组织全省开展相关知识与技能培训。
2.中国专家发现阿尔茨海默病生物标志物。首都医科大学宣武医院贾建平教授团队通过对5年至7年前认知功能正常人群进行随访,共收集了739例受试者,发现并验证外周血神经源性外泌体突触蛋白可以作为在认知障碍出现前5年至7年预测阿尔茨海默病和轻度认知障碍的生物标志物。研究成果《外周血神经源性外泌体突触蛋白预测阿尔茨海默病无症状期》在线发表在国际医学期刊《阿尔茨海默病与老年痴呆症》杂志上。
3.美国准备为“人类挑战试验”制造新冠病毒毒株。据路透社报道,美国政府科学家已开始努力制造可用于人类挑战疫苗试验的新冠病毒菌株。当地时间8月14日,美国国立卫生研究院国家过敏和传染病研究所(NIAID)在一份声明中说,这个工作仍处于初步状态,即使真正进行这种所谓病毒挑战试验也不会取代现在进行的几个新冠疫苗正常Ⅲ期临床。该机构目前已开始考量这种试验的技术可行性和伦理问题。
股市资讯
【复星医药】(1)控股子公司复宏汉霖的注射用曲妥珠单抗用于HER2阳性的转移性乳腺癌、HER2阳性的早期乳腺癌、HER2阳性的转移性胃腺癌或胃食管交界处腺癌治疗的上市注册申请获国家药监局批准(2)对卓瑞门诊新增注册资本人民币1020万元(3)控股子公司洞庭药业的盐酸阿米替林片通过仿制药质量与疗效一致性评价
【九芝堂】2020年上半年实现营业收入18.33亿元(+8.55%),归母净利润为1.97亿元(+11.71%),扣非归母净利润1.92亿元(+24.30%)
【科伦药业】获得国家药监局核准签发“恩格列净片”的《药品注册证书》
审评动向
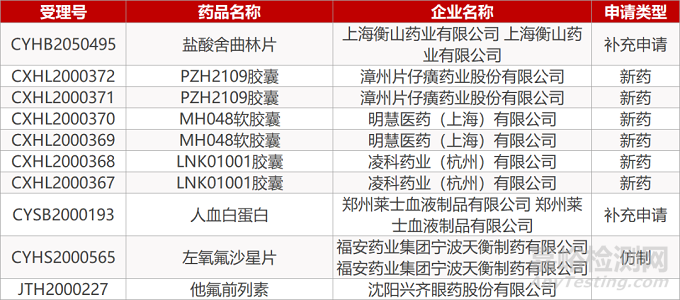
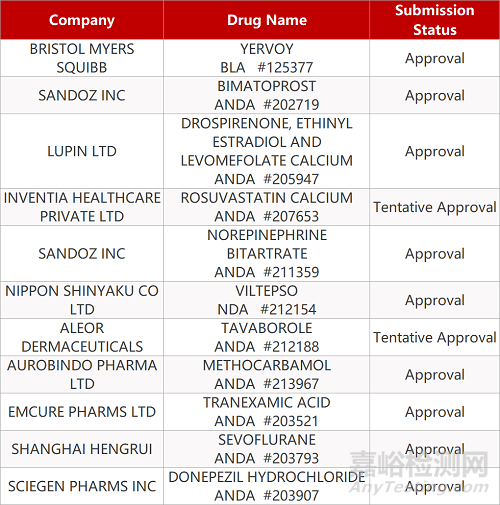
1. CDE最新受理情况(08月16日)
- The End -

来源:药研发


