您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-21 09:26
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.齐鲁哌帕西利胶囊首仿获批。齐鲁制药哌柏西利胶囊获NMPA批准上市,成为辉瑞重磅乳腺癌药物Ibrance的首仿药。辉瑞哌柏西利胶囊是全球首个获批上市的CDK4/6抑制剂,2019年全球销售收入达到49.61亿美元。该原研药已于2018年7月获批进口中国,用于与芳香酶抑制剂联用作为局部晚期或转移性HR+,HER2-绝经后女性乳腺癌患者的初始内分泌治疗。除了齐鲁制药此次获批外,先声药业也提交了上市申请。
2.复宏汉霖利妥昔单抗新适应症申报上市。复宏汉霖利妥昔单抗生物类似药HLX01用于类风湿关节炎(RA)的上市注册申请获NMPA受理。HLX01已于2019年2月获NMPA批准上市,为中国获批的首个生物类似药,目前可用于非霍奇金淋巴瘤和白血病适应症的治疗。在一项Ⅲ期临床HLX01-RA03中,HLX01联合甲氨蝶呤(MTX)在对MTX治疗应答不完全的中重度活动性RA患者中达到了“第24周(美国风湿病学会)20%缓解标准(ACR20)的受试者比例”这一主要终点。
3.糖尿病新药多扎格列艾汀即将申报上市。华领医药全球首创葡萄糖激酶激活剂多扎格列艾汀(dorzagliatin)的第二项Ⅲ期注册临床DAWN(黎明研究,HMM0302)获积极结果。在52周治疗期间,多扎格列艾汀均显示出良好的安全性和耐受性,dorzagliatin+二甲双胍治疗的患者低血糖(血糖低于<3 mmol/L)发生率低于1%;HOMA2-IR测量显示,2型糖尿病患者的胰岛素抵抗指标持续性降低。目前,dorzagliatin单药和与二甲双胍联合用药的两项Ⅲ期注册临床已完成,华领医药计划向CDE提交其新药上市申请。
4.基石药业普拉替尼拟纳入突破性疗法认定。基石药业与Blueprint公司合作开发的普拉替尼(BLU-667)获CDE纳入拟突破性疗法认定公示名单。BLU-667是Blueprint公司开发的一款口服强效RET抑制剂,此次拟纳入突破性疗法适应症为转染重排(RET)突变阳性的晚期或转移性甲状腺髓样癌(MTC)患者的系统性治疗。基石药业拥有普拉替尼单药或联合治疗在大中华地区的独家临床开发与商业化权利。
5.塔吉瑞生物第三代ALK抑制剂获批临床。塔吉瑞生物1类新药TGRX-326片获CDE两项临床试验默示许可,拟开发用于ALK阳性或/或ROS1阳性晚期非小细胞肺癌(NSCLC)的治疗。TGRX-326是一款EML4-ALK靶向的第三代ALK抑制剂,已在临床前研究中显示出对野生型及大多数突变型ALK激酶具有优异的活性和高选择性;同时它对ROS1激酶也具有特异的生物活性,可用于治疗ROS1融合基因阳性引起的NSCLC。
国际药讯
1.FDA批准首款活动性狼疮性肾炎疗法。葛兰素史克BLyS靶向单抗Benlysta(belimumab)获FDA扩展适应症,用于治疗正在接受标准疗法的活动性狼疮性肾炎(LN)。这也是FDA批准的首款针对LN的疗法。在一项Ⅲ期临床BLISS中,与安慰剂+标准治疗相比,Benlysta联合标准治疗显著提高肾脏缓解的患者比例(43%vs32%,p=0.0311);所有4个主要次要终点均达到统计学显著性,包括完全肾脏缓解和出现肾脏相关事件或死亡所需时间。Benlysta此前已获批治疗系统性红斑狼疮和狼疮性肾炎。
2.阿斯利康奥希替尼获FDA批准新适应症。FDA批准阿斯利康第三代EGFR抑制剂奥希替尼(Tagrisso)作为首个辅助疗法,治疗肿瘤携带特定类型基因突变的非小细胞肺癌(NSCLC)患者。在一项评估Tagrisso用于EGFR外显子19缺失或外显子21 L858R突变阳性并接受了肿瘤完全切除的早期NSCLC患者的Ⅲ期临床中,Tagrisso治疗与安慰剂相比使患者疾病复发几率降低80%。此前,Tagrisso已获批治疗经治NSCLC患者;一线治疗EGFR外显子19缺失或外显子21 L858R突变的转移性NSCLC。
3.吉利德CAR-T细胞疗法Tecartus获欧盟有条件批准。欧盟委员会有条件批准吉利德旗下Kite制药自体CD19靶向CAR-T疗法Tecartus(KTE-X19)上市,用于经过两次或更多次的系统治疗(包括Bruton酪氨酸激酶BTK抑制剂)的复发/难治性套细胞淋巴瘤(R/R MCL)成年患者。在一项关键Ⅱ期ZUMA-2研究中,先前已接受过至少5种治疗方案(包括一种BTK抑制剂)的R/R MCL成人患者单次输注Tecartus后,总体缓解率(完全或部分)为93%,其中67%的患者达到了完全缓解。
4.安进KRAS G12C抑制剂在美申报上市。安进已向FDA提交其在研KRAS G12C抑制剂sotorasib的新药申请,用于治疗至少接受过一种全身治疗的携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。FDA将在实时肿瘤学审评(RTOR)试点项目下对NDA进行审评。今年9月发表在《新英格兰医学杂志》上的临床试验数据显示,在这类NSCLC患者中,sotorasib达到32.2%的客观缓解率和88.1%的疾病控制率,中位无进展生存期为6.3个月。
5.K药组合治疗子宫内膜癌Ⅲ期临床结果积极。默沙东PD-1抑制剂Keytruda与卫材激酶抑制剂LENVIMA® (lenvatinib,乐伐替尼)的组合疗法,在治疗既往接受过至少一种铂类药物治疗的晚期子宫内膜癌的III期临床KEYNOTE-775 / Study 309中达到了总生存期(OS)和无进展生存期(PFS)的双重主要终点,以及客观缓解率(ORR)的次要疗效终点,与化疗方案相比临床效果显著,这一结果将加速监管机构在该适应症上的审批。
6.诺华收购神经科学领域研发公司Cadent。诺华宣布正在以2.1亿美元的价格和未来可能的5.6亿美元里程碑付款,收购Cadent公司。Cadent公司专注于神经科学领域,于2017年与Luc公司和Ataxion Therapeutics合并后成立。此次收购,诺华将拥有Cadent的两个临床期NMDAr资产(CAD-9303和MIJ-821),以及拟用于运动障碍(例如小脑共济失调SCA)的在研SK通道阳性变构调节剂CAD-1883。CAD-9303为正在开发用于精神分裂症的NMDAr阳性变构调节剂;而MIJ-821是NMDAr负变构调节剂,可选择性地调节与抑郁症相关的NMDA受体的子集。
医药热点
1.冠脉支架医保节约资金医院可部分留用。国家医保局公布《关于国家组织冠脉支架集中带量采购和使用配套措施的意见》。《意见》明确,完善对医疗机构的激励约束机制,参照国家组织药品集中采购医保资金结余留用有关规定,各省级医保部门要指导统筹地区对冠脉支架集采范围内品种实施医保资金单列预算管理,医保资金节约部分,经考核按不高于国家组织药品集中采购结余留用的比例由医疗机构结余留用。
2.中国太平首家康复医院在沪投入试运行。中国太平保险集团斥资10亿打造的首个医院项目——上海太平康复医院于19日正式投入试运行。该院以老年医学和康复医学为重点发展方向,初步形成“心肺康复、睡眠康复、重症康复”三大主要特色,旨在打造集“预防保健、初级诊疗、康复医疗、急重症处置、慢病管理”等多功能于一体的国内一流康复医院领先品牌。该院位于张江科学城上海国际医学园区,总建筑面积约8.8万平方米。
3.清华大学与珠海共建智慧医疗研究院。清华大学与珠海市人民医院医疗集团共建的智慧医疗研究院项目于16日正式启动。该研究院由中国工程院院士、清华大学附属北京清华长庚医院院长董家鸿担任院长。该研究院将重点研究智慧医疗、智慧管理、智慧服务、智慧科教,聚焦智慧医疗核心技术、重大疾病标准数据集、智能手术机器人、智慧医联体信息平台等技术与产品的研发,共建新一代智慧健康医疗生态。
股市资讯
【双成药业】公司产品“注射用胸腺法新”已通过注射剂仿制药质量和疗效一致性评价。
【微芯生物】产品西奥罗尼胶囊被药审中心纳入拟突破性治疗品种公示名单。
【海辰药业】公司收到国家药监局核准签发的“注射用盐酸兰地洛尔”《药品注册证书》。
审评动向
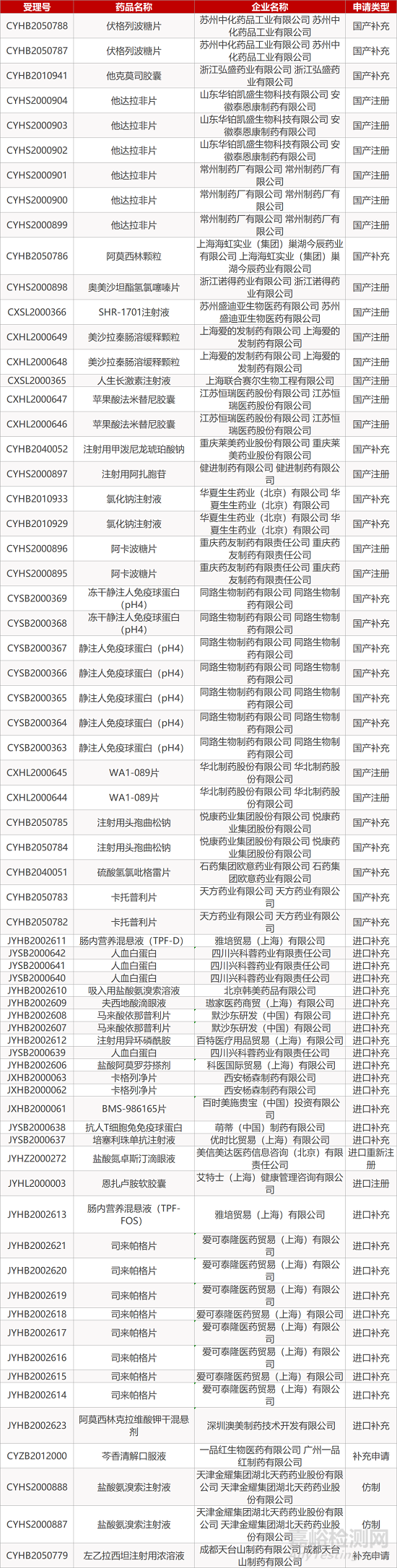
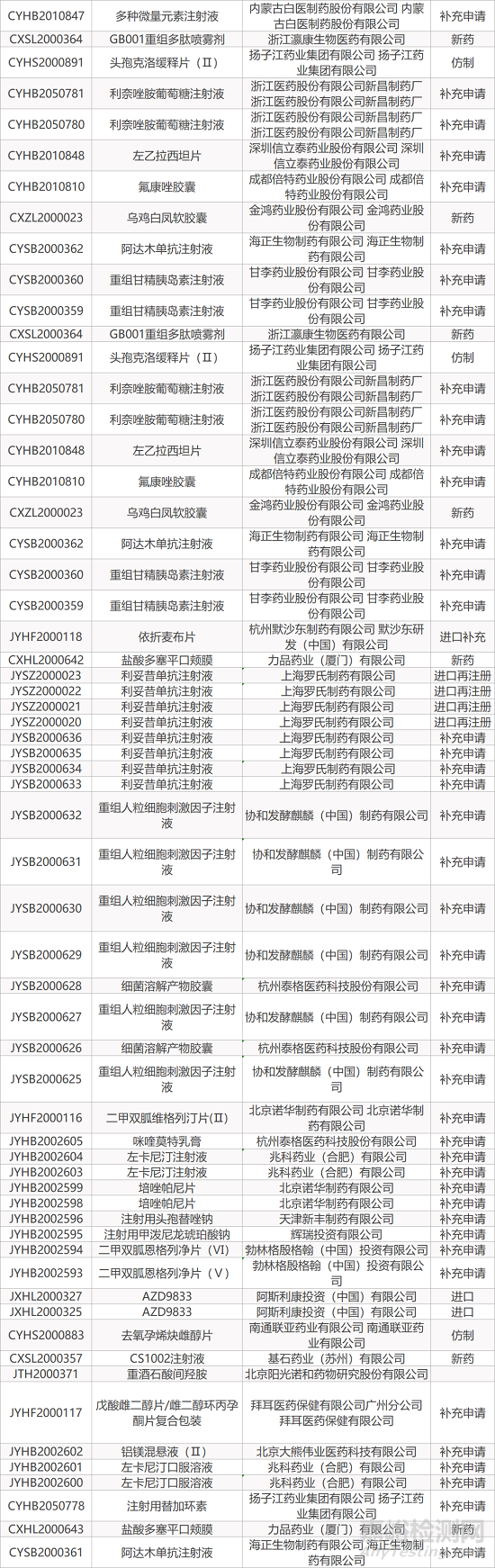
1. CDE最新受理情况(12月20日)
- The End -

来源:药研发


