您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-31 09:31
各种药片、胶囊是非常传统的给药形式,也是很多人对药物的最初印象。即使在科技飞速发展的今天,药物的形式已经有了更多的选择,但是,口服制剂依然在市场上占比举足轻重,对于广大患者而言,也是非常便捷、友好的给药方式。
中国有句古话“良药苦口利于病”,显然,药物口服由来已久。在常规的认知中,口服是一种传统、低成本的给药形式,但是,对于很多全新的候选药物分子来说,成为优秀的口服药物并不像看起来那么简单。
最初,人类从自然界中发现能够治疗疾病的药物,这些分子往往具有天然的成药属性。随着很多“低处的果实”已经被摘取,组合化学以及药物设计在新药开发中大量应用,越来越多的候选药物分子呈现了更加亲脂性的趋势,它们有着更大的分子量、更小的极性,并且难以在水中很好的溶解。如果药物在水中溶解性很差,那么就可能难以被人体吸收。
近年来的一项研究中显示,接近90%的在研管线分子难以水溶。溶解性的表现一度成为了很多候选药物通关失败的归因。
溶解困难,依旧可以成为口服“良药”
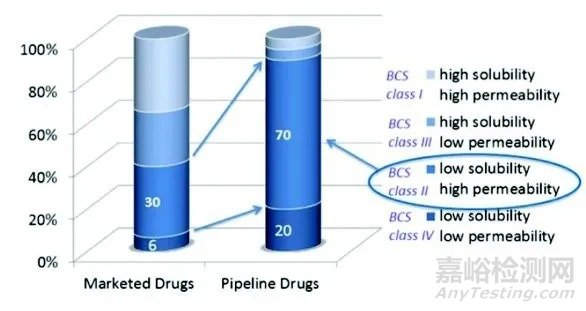
▲图片来源:参考资料[1]
早期筛选获得有希望的先导化合物,如果溶解度很低,渗透性不好,那么,意味着生物利用度可能会很低,后期研发路上将会挑战重重,真正成药前有一系列的问题需要面对,失败的风险将显著增加,比如达到治疗目的就需要加大摄入的剂量、API成本增加、个体差异的副作用、患者依从性差等。如果“顺其自然”,化合物则很可能在最后“沉沙折戟”。
不过采用合适的技术和策略,不仅能够在很大程度上避免上述情况,还可以提高体内吸收及药效,显著降低剂量及相关的毒性、改善患者的依从性等,最终提升研究和开发的成功可能。一个有希望的先导化合物,即使溶解困难,依旧可能成为未来拯救病患的“良药”。
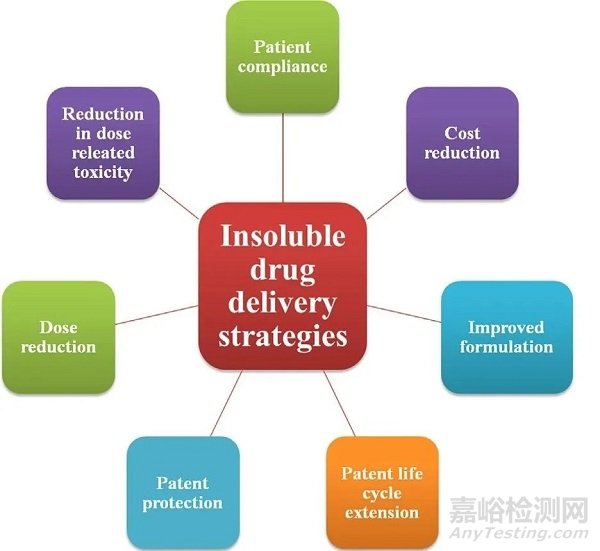
▲积极采用难溶分子的药物递送策略会为新药开发带来哪些优势(图片来源:参考资料[2])
如何提升难溶分子的生物利用度呢?在大多数情况下,口服的药物主要由肠道吸收,进入血液,起到治疗疾病的作用。其间,药物递送的评估需要经历两次关键的“考验”,其一是在消化道中能否快速溶解;其二是能否穿越肠道壁的重重粘膜与细胞,进入血液。在新药开发过程中,这两项“考验”分别称之为溶解性和渗透性,是衡量一个候选药物分子是否能够易于成药的关键指标。能够轻易达标的分子往往是分子量较小、极性适中,易于水溶的。
如何让难溶的API分子更好地吸收呢?可以尝试通过多种方式致力于提升生物利用度,比如基于脂质溶剂的液体胶囊制剂,制备无定形态的热熔挤出和喷雾干燥,以及通过物理方法减小固体粒径的过微米化,以及纳米悬浮等技术等。开发者需要综合考量开发阶段的不同需要,通过一系列体内、体外的相关研究,才能对生物等效性的方案给出最优的评价。
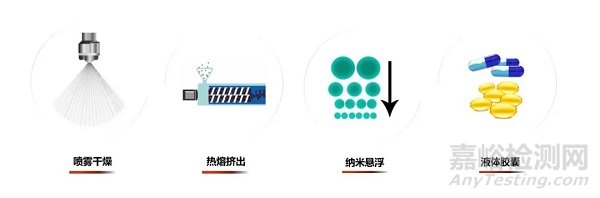
▲通过多种制剂能力帮助合作伙伴的候选药物分子提升生物利用度
其中,喷雾干燥在近年来越来越得到了业界的关注。研究人员可以通过合适的有机溶剂将难溶的API分子和高分子聚合物共同溶解。之后,通过以喷雾方法快速干燥的方法去除有机溶剂,那么,就得到了理想的无定形态固体分散体(Amorphous solid dispersions ,ASDs)。之后,药物在固体分散体的高能状态,在遇到水时得到释放以达到更稳定状态,这样提高了难溶药物在病患体内的生物利用度。
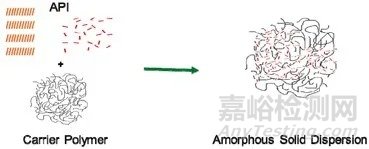
▲制剂技术中获取无定形固体分散体的原理(图片来源:参考资料[3])
在药物制剂过程中,无定形固体分散体是将活性药物分子(API)嵌入到高分子聚合物形成的固体基质中来获得的。高分子聚合物是交联的网状结构,犹如一个复杂多孔的笼子,可以作为无定形固体分散体的支架。API分子分散在高分子聚合物的分子中,便组成一种固态无定形分散体。
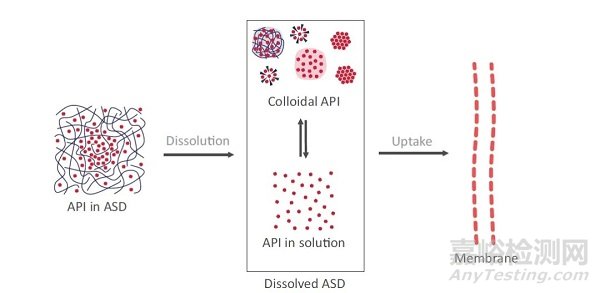
▲以无定形固体分散体摄取药物的基本概念(图片来源:参考资料[4])
通过制剂获取的无定形态分散体在溶解的过程中,除了经典的分子溶解外,还存在很多其他的胶体状态,比如富药颗粒、胶束以及晶体悬浮物等,这是一种混合的胶体体系,将以多种形态被肠道所吸收。
喷雾干燥技术的特点
目前,喷雾干燥技术的受欢迎程度大大超过了其他增溶技术,原因有很多。首先,它可以快速开发用于体外筛选试验,以了解其作为问题药物生物利用度增强技术的有效性,并且只使用少量的材料,这样对早期药物研发有着非常大的吸引力。我们可以将其与另一种可获得无定形固体分散体的技术热熔挤出进行对比,后者需要更多的开发工作(时间)和相当多的API材料。更重要的是,热熔挤出所使用的化合物和聚合物/赋形剂必须在高温下处理,而高温不适用于热敏性原料药和聚合物赋形剂。相比于热熔挤出,喷雾干燥所使用的温度和溶剂体系相关,可以通过筛选合适的溶剂,使得温度控制在较低的安全范围内。
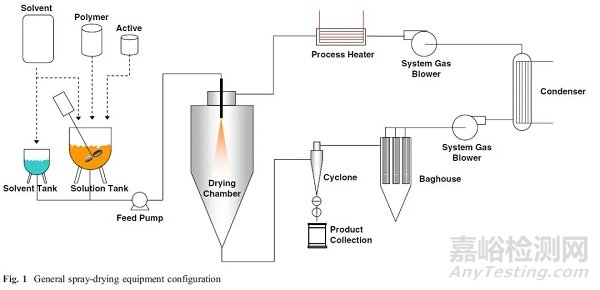
▲喷雾干燥示意图(图片来源:参考资料[5])
喷雾干燥技术的其他优点是,它形成粉末状固体,可以灵活选择先进的制剂技术。例如,通过辅料或包衣掩盖一些API的不良味道,更适用于儿童用药或者咀嚼片、舌下给药等多种剂型的开发;可以通过包衣等辅助技术,改变药物的释放性质,如做成肠溶或者缓释,控制肠道吸收区域,以及单次服用可以获得更长的作用时间;另外,相比于液体胶囊等技术,喷雾干燥可以做到更小体积、更高载药量,更容易服用,从而提升患者的依从性。
开发难溶分子,机遇挑战并存
任何技术都会有其应用的局限性。虽然获得无定形分散体的原理并不复杂,但实际开发中也并非如此简单,挑战也依然存在。对于喷雾干燥而言,除了会导致额外的开发和生产成本外,还需要考虑由工艺开发带来的影响。
首先,选择合适的溶剂体系以及高分子聚合物很重要,不但要考虑溶解性,同时也要考虑稳定性的问题。其次,喷雾干燥会引入额外的溶剂,需要进一步去除溶剂,并进行相关的评估;第三,因为从热力学角度来看,无定形态相比于晶体而言,是一种高能量状态。不当的配方在生产后还会发生API结晶,因此,稳定的保质期仍然是一个重要的研究内容。另外,虽然喷雾干燥有非常多的优势,但是,一旦在新药开发早期使用了这种方法,就意味着在后期的规模化生产中需要满足同样的工艺,但现实是要将喷雾干燥技术应用到大规模商业化生产当中,不仅需要大量的资金投入在特制的厂房设备当中,更需要一支高水平的含工艺开发、工程技术,以及质量保证等专业团队做支撑,因此目前国际上具备大规模商业化喷雾干燥能力的CDMO凤毛麟角。这成为限制了喷雾干燥技术在药物开发和商业化应用的原因之一。新药开发者不得不考虑制剂工艺在整个新药开发周期中的连续性,以及使用喷雾干燥技术在后期生产时所面临的技术和速度瓶颈。
穿越蓝海,面对更广阔的天地
可以预见,随着管线分子越来越复杂,会有更多的难溶候选化合物出现,增溶技术也将会得到更加广泛的应用。
据统计,过去十年有超过100多款口服新分子实体(NME)获FDA批准上市,近33%在制剂研发阶段的溶解度问题,被增溶技术所攻克。全球小分子新药管线兴盛发展,虽然在化学药的制剂开发阶段,仍无法避免地遇到近90%的难溶性分子无法被人体吸收的痛点,但随着诸如喷雾干燥工艺的制剂增溶技术的成熟应用,口服药物的生物利用度技术在新药开发中的运用开始显现逐年攀升之势。总的来说,市场动向呈现出了药物创新者对喷雾干燥等生物利用度技术的兴趣和需求;随着小分子创新药的管线发展,我们有理由相信,未来基于难溶分子的新药研发依旧会是一片蓝海。
参考资料:
[1] R. Lipp; The Innovator Pipeline: Bioavailability Challenges and Advanced Oral Drug Delivery Opportunities, Am. Pharm. Rev., 2013. [1] https://www.americanpharmaceuticalreview.com/Featured-Articles/135982-The-Innovator-Pipeline-Bioavailability-Challenges-and-Advanced-Oral-Drug-Delivery-Opportunities/
[2] Kalepu Sandeep, Nekkanti Vijaykumar. Insoluble drug delivery strategies: review of recent advances and business prospects. Acta Pharmaceutica Sinica B (2015), DOI:10.1016/j.apsb.2015.07.003
[3] Vaka S., Bommana M., Desai D., Djordjevic J., Phuapradit W., Shah N. (2014) Excipients for Amorphous Solid Dispersions. In: Shah N., Sandhu H., Choi D., Chokshi H., Malick A. (eds) Amorphous Solid Dispersions. Advances in Delivery Science and Technology. Springer, New York, NY
[4] Andreas Schittny, Jörg Huwyler & Maxim Puchkov (2020) Mechanisms of increased bioavailability through amorphous solid dispersions: a review, Drug Delivery, 27:1,110-127, DOI: 10.1080/10717544.2019.1704940
[5] Dobry, D. E. et al.,A Model-Based Methodology for Spray-Drying Process Development, J Pharm Innov. 2009 Sep; 4(3): 133–142, DOI: 10.1007/s12247-009-9064-4

来源:药明康德


