您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-01 17:47
针对EGFR的靶向药物,深刻地改变了肿瘤的治疗方式,给患者带来了极大的获益。经过二十年的发展,对EGFR靶点的药物机理了解日益深入,围绕EGFR及其耐药靶点的药物研究日益增多。本文对这一经典靶点相关药物临床研究进行及伴随诊断解决方案进行综述式简述和探讨。
EGFR靶点概述
01、什么是EGFR基因?
EGFR是人体细胞正常增殖的重要信号传导分子,位于7号染色体,7p12区,在不同上皮来源组织中都可以检测到该基因的表达,表达蛋白活性激活过程如图1所示:机体调控分泌的生长因子(EGF、TGFα等)与细胞外受体相结合后,启动EGFR形成跨膜二聚体,带动蛋白质三维结构转换,细胞内TK结构域与ATP产生生化反应,ATP变成ADP,TK磷酸化激活EGFR酶活性。
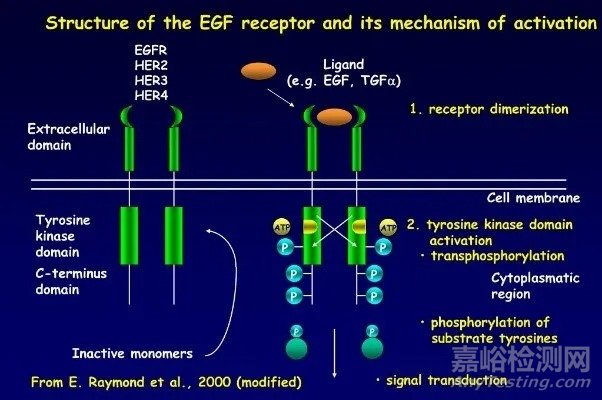
图1 EGFR结构及激活机制示意图
活化的EGFR可以将增殖信号和抗凋亡信号通过PI3K-AKT-mTOR、Ras-Raf-MEK-ERK1/2等多个下游信号传导途径,传递至细胞核,控制细胞生长和分裂,具体路径见图2。
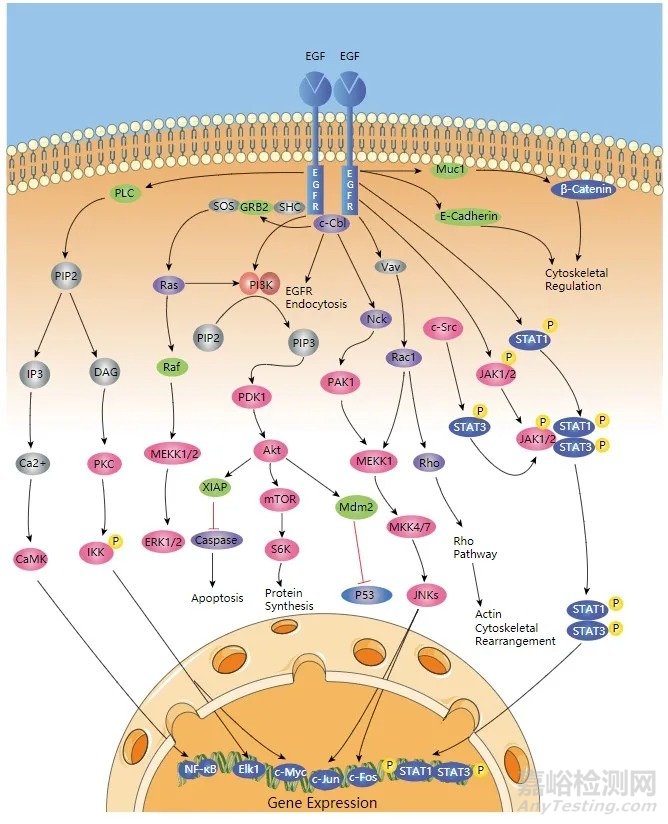
图2 EGFR信号传导途径
02、 EGFR信号过表达导致肿瘤发生
上世纪八十年代以来,发现多种上皮来源的实体肿瘤组织如非小细胞肺癌、结直肠癌、胰腺癌、肾癌、膀胱癌,存在EGFR高表达的现象,并且此部分患者预后不佳,提示EGFR过度传递生长信号可能是肿瘤发生发展的原因之一。经过多年的研究,发现EGFR以下几种形式导致生长信号过度表达,并对机体分泌的抗生长信号不敏感。
1) 信号源过表达:如EGF,HGF等生长因子高表达。
2) EGFR自身过表达,如拷贝数增多。
3) EGFR突变导致生长信号活化。
4) 下游信号通路活化突变,如KRAS、BRAF突变等。
上述EGFR靶点异常情况,在不同人群中的频率存在较大差异。对比非小细胞肺癌NCCN和CSCO指南,中国肺腺癌患者EGFR突变率在40-60%,美国患者约10%;但是在纯肺鳞癌中,中美患者突变率<4%[1-2]。
由于EGFR不仅仅是肺癌的驱动基因,在其他肿瘤中也存在[3];TKI小分子药物也可能结合EGFR之外的酪氨酸激酶家族成员的TK区域,已有TKI药物开展了其他癌种、络氨酸激酶靶点的临床研究。2005年11月,FDA批准厄洛替尼与吉西他滨联合用于治疗局部晚期或转移性胰腺癌的治疗。
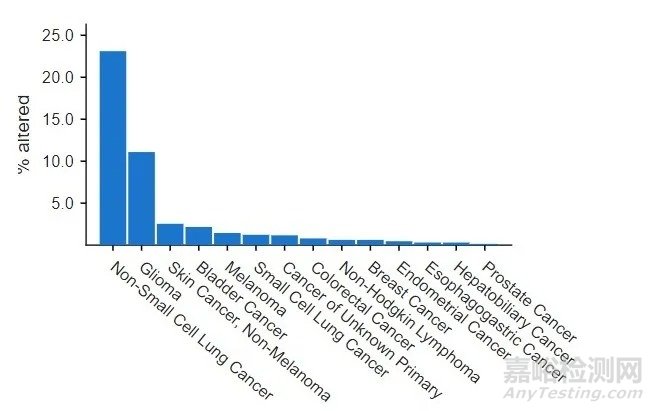
图3 EGFR在不同癌种的突变率
03、获批靶药概览
EGFR(表皮生长因子受体,epithelial growth factor receptor)作为热门药物靶点,中美已上市靶向药物如下[4-5]。
表1 中美已上市EGFR靶向药物列表
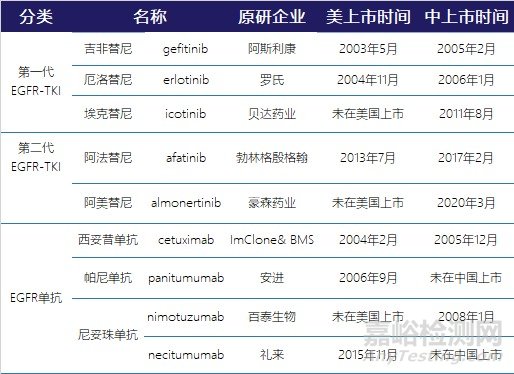
从上世纪九十年代开始,针对EGFR这一个抗肿瘤靶点,不同研究者开展了不同的药物开发策略。从已上市产品来看,主要有抑制细胞外配体-受体结合的EGFR单抗类药物,和抑制细胞内ATP-TK结合的TKI(tyrosine kinase inhibitor)小分子化学药物。
由于单抗类药物和TKI类药物的开发策略、适用人群、检测方法、伴随诊断解决方案不同,下文主要围绕TKI类药物开展。
EGFR靶药临床研究进展
01、三代EGFR-TKI简介
吉非替尼(gefitinib)是最早出现的TKI药物,在1998年的一期临床试验中即发现,部分化疗后进展NSCLC患者对药物反应非常迅速,肿瘤明显缩小[6-7]。吉非替尼设计之初是针对EGFR高表达的,但临床试验却未发现EGFR高表达和疗效有相关性[8-9]。
直到2004年才发现编码EGFR-TK结构域的基因片段上有exon 19del和L858R突变时,药物有很高的有效率。两类突变可导致TK结构激活,是肿瘤发生发展的驱动因素,药物结合TK结构域后,通过抑制酪氨酸激酶活化,起到抗肿瘤的作用[10-11]。紧接着在2005年发现T790M突变的出现可以导致原本疾病缓解的患者出现进展,因为T790M突变会形成空间位阻,阻碍药物与TK的结合,肿瘤继续进展[12]。上市较早的吉非替尼、厄洛替尼、埃克替尼均会产生T790M耐药,称为第一代TKI。
后续研发上市的阿法替尼、达克替尼作为第二代TKI,策略是将小分子药物共价结合在EGFR、Her2的TK结构域,增强TK抑制能力,但是仍然不能克服T790M导致的耐药。奥希替尼和阿美替尼能够克服T790M耐药,称为第三代TKI药物。
简单归纳1-3代药物的特点如下:
表2 三代EGFR-TKI药物的比较

在具体涉及到患者用药治疗时,临床会结合其适应症(疾病分期、治疗阶段)、EGFR基因突变状态等因素做出综合选择。
02、EGFR-TKI药物临床试验进展
回顾EGFR-TKI药物的适用症发展历史,FDA于2003年5月5日加速审批第一个EGFR-TKI药物吉非替尼(gefitinib)上市,适用于三线治疗:用于局部晚期或转移性非小细胞肺癌患者,在铂类和多西紫杉醇化疗均失败后的单药治疗。当时并不清楚药物的临床作用机理,在未筛选EGFR突变的三线治疗患者群体开展的临床试验IDEAL1和IDEAL2中,客观缓解率(ORR)从8.8%到19.0%不等[9]。自2004年报道EGFR突变NSCLC患者对药物更敏感[10-11]之后,陆续开展了一系列的多中心临床研究,EGFR突变患者临床获益不断扩大,下表归纳了部分研究结果。
表3 EGFR-TKI药物部分临床试验结果

IPASS研究最早证明了晚期NSCLC腺癌患者,EGFR突变阳性时一线治疗方案优先选择TKI药物。IPASS结果显示晚期非小细胞肺腺癌患者中EGFR突变率59.7%,exon 19del 突变和L858R突变患者占所有检出突变患者的90%。吉非替尼治疗组EGFR突变患者中位PFS 为9.8月、ORR为71.2%,显著优于化疗组(中位PFS为6.4月、ORR为32.2%)。而吉非替尼治疗组中突变阴性患者中位PFS少于2月,ORR为1.1%,显著低于化疗组[13]。
由于一代和二代TKI治疗患者50%会产生T790M耐药进展,三代TKI药物奥希替尼首先用于T790M耐药患者的二线治疗[14]。FLAURA临床研究对比了奥希替尼和一代TKI药物用于一线治疗的效果:中位PFS18.9个月VS10.2个月[15]。由于一线TKI耐药之后,只有50%的患者可以序贯使用奥希替尼,获益不如一线治疗直接使用奥希替尼,所以奥希替尼已经上升到晚期NSCLC的一线治疗路径。
吴一龙等2020年发表的研究结果显示,在ⅠB至ⅢA可手术的NSCLC患者中,EGFR阳性患者术后辅助治疗选择奥西替尼,相比安慰剂可以显著延长无病生存期(DFS,IB期患者88% vs 71%;II期患者分别为91% vs 56%;IIIA期患者分别为88% vs 32%)[16]。FDA于2020年12月批准奥希替尼用于辅助治疗,并纳入NCCN指南[1]。
上述TKI药物都是基于单药治疗进行的临床研究。在联合治疗方面,一代TKI药物厄洛替尼/吉非替尼联合化疗或者抗血管生成治疗,已开展了多项研究,在此不再赘述。针对中国适用人群的Ⅲ期RCT研究表明厄洛替尼联合贝伐单抗,相比较厄洛替尼单药PFS为18.0月VS11.3月[17],因此厄洛替尼联合贝伐单抗已经写入CSCO指南,作为一线治疗的二级推荐[1-2]。
EGFR突变检测
目前临床常见的EGFR突变检测方法包括荧光PCR法(ARMS、Super ARMS)、数字PCR(ddPCR)和 NGS法等,各方法的主要特点比较如下:
表4 EGFR检测方法的比较
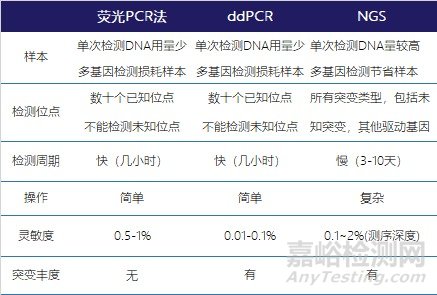
不同方法之间具有一定的互补性,《二代测序技术在NSCLC中的临床应用中国专家共识(2020版)》中共识2:针对敏感型突变发生率高的NSCLC患者,常规基因检测结果为阴性时,建议使用中国NMPA或美国FDA批准的NGS产品进行复检。现在国内已经有多个荧光PCR、NGS试剂盒获批,尽量选用已获批试剂盒进行检测。
泛生子一直致力于NGS的技术研发、肿瘤药物靶点检测。今年2月份,泛生子的人类8基因突变联合检测试剂盒(半导体测序法)(国械注准20203400072,以下简称泛生子肺癌8基因试剂盒)获国家药品监督管理局批准上市(点击链接了解更多),该试剂盒是首款获批搭载泛生子“一步法”专利技术(中国发明专利 ZL 201710218529.4)的肺癌临床诊断试剂盒,可一次性检测与非小细胞肺癌患者靶向治疗密切相关的8个基因突变和融合—EGFR / ALK / ROS1 / BRAF / KRAS / HER2 / MET / PIK3CA,其中,EGFR基因中19号外显子缺失(19del)、L858R点突变可用于吉非替尼片、盐酸埃克替尼片伴随诊断检测,T790M点突变用于甲磺酸奥希替尼片的伴随诊断检测,与对比试剂研究总符合率>95%,该试剂盒贴合NCCN指南,具有检测精准、样本用量少、检测周期短等优势,可为NSCLC患者提供精准的靶向治疗指导。
EGFR与伴随诊断
早在2014年8月,美国FDA就颁布了首版《体外伴随诊断试剂指导原则》[20]。我国NMPA在2020年7月和8月分别发布了《基于同类治疗药品的肿瘤伴随诊断试剂说明书更新与技术审查指导原则(征求意见稿)》和《已上市抗肿瘤药物的伴随诊断试剂临床试验指导原则(征求意见稿)》[21-22]。
根据NMPA指导原则,肿瘤伴随诊断试剂对采集自肿瘤患者的样本进行检测,其结果可以为患者使用抗肿瘤药物的安全性和有效性提供重要的信息,包括:确定最有可能从药物中受益的患者;确定该药物相关严重不良反应风险较大的患者;确定已经过充分研究具备安全性和有效性的人群亚组等。
EGFR伴随诊断试剂的临床试验分为两部分:一部分为临床检测准确性研究,一部分为伴随诊断用途的临床验证。中美两个药监部门在对于伴随诊断领域的监管模式非常类似。准确验证部分可以选择已上市试剂盒,或者一代测序、技术成熟的二代测序或临床公认的基因检测技术[21]。
临床验证部分,原研伴随诊断试剂可提交药物临床试验资料作为伴随诊断用途验证的临床试验资料,注意应与抗肿瘤药物上市过程中递交药品审评部门的最终的临床试验资料一致。新研制伴随诊断试剂,预期用途的验证可采取与原研伴随诊断试剂进行一致性比对、桥接试验、已上市抗肿瘤药物疗效的观察性研究等方式[21],其中包括适应症及样本选择、预期用途及位点选择、一致性评价、药物疗效等研究。
由于EGFR药物依然处于开发和临床验证阶段,这一过程需要不断地收集药物疗效相关性数据来加以证明和调整,尤其对于19del、L858R、T790M之外的突变,将是个不断持续的工作。NMPA已经发布了《真实世界证据支持药物研发与审评的指导原则(试行)》[23],《真实世界数据用于医疗器械临床评价技术指导原则(征求意见稿)》[24],希望后续会加速EGFR靶药和伴随诊断试剂的适应症调整。
泛生子肺癌8基因试剂盒是国内获批的基于DNA水平检测EGFR突变的NGS产品,可同步搭载已获批测序仪GENETRON S5(国械注准:20193220820)及全自动加样系统GENETRON Chef(渝械注准20192220364)配合自动化报告出具系统,可在临床院内实现2-3天的快速检测,为广大患者的治疗争取宝贵时间,这种对临床终端检测刚需的解决方案,同时将非常有助于推动基于本试剂盒开展伴随诊断的药物未来的商业化布局。我们非常欢迎与相关制药企业合作完成更多EGFR靶向药物的伴随诊断临床验证,增加指导特定药物用药的临床适应症,为更多患者带来精准治疗的福音。
参考文献
1. http://www.nccn.org/professionals/physician_gls/default.aspx
2. http://www.csco.org.cn/cn/index.aspx
3. https://www.oncokb.org/
4. https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm
5. http://app1.nmpa.gov.cn/data_nmpa/face3/dir.html?type=yp&CbSlDlH0=qGqxcaqtcGLtcGLtc7AUkdzGX6LJJsOr_5cEWvs_znAqqqL
6. M.G, Kris, and, et al. Objective regressions in non-small cell lung cancer patients treated in Phase I trials of oral ZD1839 (IressaTM), a selective tyrosine kinase inhibitor that blocks the epidermal growth factor receptor (EGFR)[J]. Lung Cancer, 2000.
7. Negoro S . Final results of a phase I intermittent dose-escalation trial of ZD1839 ( Iressa ) in Japanese patients with various solid tumours[J]. Proc Am Soc Clin Oncol, 2001, 20.https://www.nobelprize.org/prizes/medicine/1992/summary/
8. Wakeling A E , Guy S P , Woodburn J R , et al. ZD1839 (Iressa) An Orally Active Inhibitor of Epidermal Growth Factor Signaling with Potential for Cancer Therapy[J]. Cancer Research, 2002, 62(20):5749-5754.
9. Cohen M H . FDA Drug Approval Summary: Gefitinib (ZD1839) (Iressa ) Tablets[J]. The Oncologist, 2003, 8(4):303-306.
10. Paez J G, Jänne P A, Lee J C, et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science, 2004, 304(5676): 1497-1500.
11. Lynch T J, Bell D W, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non–small-cell lung cancer to gefitinib. New England Journal of Medicine, 2004, 350(21): 2129-2139.
12. Kobayashi S, Boggon T J, Dayaram T, et al. EGFR mutation and resistance of non–small-cell lung cancer to gefitinib. New England Journal of Medicine, 2005, 352(8): 786-792.
13. Mok T S, Wu Y L, Thongprasert S, et al. Gefitinib or carboplatin–paclitaxel in pulmonary adenocarcinoma. New England Journal of Medicine, 2009, 361(10): 947-957.
14. Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med. 2017;376:629–640.
15. Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018;378:113–125.
16. Wu Y L , Tsuboi M , He J , et al. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer[J]. New England Journal of Medicine, 2020, 383(18).
17. Zhou Q , Wu Y L , Cheng Y , et al. CTONG 1509: Phase III study of bevacizumab with or without erlotinib in untreated Chinese patients with advanced EGFR-mutated NSCLC[J]. Annals of Oncology, 2019, 30(Supplement_5):v603-.
18. 周彩存. 二代测序技术在NSCLC中的临床应用中国专家共识(2020版)[J]. 中国肺癌杂志, 2020(9):741-761.
19. Hung, Lung, Lin, et al. Comparative Analysis of Two Methods for the Detection of EGFR Mutations in Plasma Circulating Tumor DNA from Lung Adenocarcinoma Patients[J]. Cancers, 2019, 11(6):803-.
20. https://www.fda.gov/medical-devices/vitro-diagnostics/companion-diagnostics
21. https://www.cmde.org.cn/CL0065/21446.html
22. https://www.cmde.org.cn/CL0065/21242.html
23. https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20200107151901190.html
24. https://www.cmde.org.cn/CL0066/20139.html

来源:Internet


