您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-26 07:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
Moderna启动新冠mRNA增强型疫苗临床试验。Moderna公司针对突变株B.1.351设计的突变体特异性新冠疫苗mRNA-1273.351即将在美国国家过敏和传染病研究所(NIAID)开展Ⅰ期临床,在未接种新冠疫苗的受试者以及已接种过mRNA-1273疫苗的临床研究受试者中评估免疫原性和安全性,以确定mRNA-1273.351是否可以增强针对B.1.351突变株的免疫力。目前mRNA-1273.351疫苗已运往NIAID,NIAID将在收到FDA授权后启动这一临床研究。
国内药讯
1.国药集团新冠灭活疫苗保护效力达72.51%。国药中国生物武汉所新冠疫苗发布Ⅲ期临床积极结果。该疫苗于2020年7月16日起在阿联酋等多个国家开展国际Ⅲ期研究,期中分析数据显示:新冠灭活疫苗接种后安全性良好,两针接种后,疫苗接种者均产生高滴度抗体,中和抗体阳转率为99.06%,疫苗针对由新冠病毒感染引起的疾病(COVID-19)的保护效力达到72.51%。
2.亿胜生物干眼症新药在美达Ⅲ期试验终点。亿胜生物与Mitotech公司联合开展的美国Ⅲ期临床VISTA-2获积极顶线数据。该研究评估靶向线粒体心磷脂过氧化的抑制剂SkQ1用于治疗干眼症(DED)的效果。在泪液分泌测试评分较高的受试者亚组中,与安慰剂组相比,SkQ1治疗组28天后患者的中心荧光素染色的基线变化具有统计学意义的显著改善(p<0.05);而且SkQ1显示与人工泪液相似的耐受性,及良好的安全性。
3.浙江医药HER2靶向抗体偶联药物获批临床。浙江医药和新码生物联合申报的注射用重组人源化抗HER2单抗-AS269偶联物(ARX788)获得临床试验默示许可,拟开发用于治疗胃癌和胃食管连接部腺癌。ARX788是Ambrx公司开发的一款HER2靶向抗体偶联药物(ADC),刚获FDA授予治疗胃癌(包括胃食管结合部腺癌)的孤儿药资格,以及治疗HER2阳性乳腺癌的快速通道资格。目前该产品正在中国进行4项临床试验,适应症包括HER2阳性乳腺癌和胃癌。
4.阿斯利康红斑狼疮创新疗法在华获批临床。阿斯利康在研单抗anifrolumab注射液获国家药监局临床试验默示许可,拟开发用于治疗中重度活动性的系统性红斑狼疮。anifrolumab是一款抑制I型干扰素信号通路的单抗,目前处于Ⅲ期临床开发阶段。一项关键性Ⅲ期试验TULIP 2结果显示,anifrolumab在52周时明显改善狼疮综合评价指数(47.8%vs31.5%)。此外,该单抗还对几个次要终点做出了统计显著改善。
5.君实PD-1/TGFβ双抗申报临床。君实生物JS201注射液临床申请获CDE受理。JS201是一款PD-1/TGFβ双特异性抗体,JS201的PD-1抗体部分基于特瑞普利单抗,临床前研究显示,同时抑制PD-1和TGFβ通路较之单药疗法可增强T细胞激活,疗效更佳且安全性可控。目前,国内未有其他企业开发PD-1/TGFβ双抗,但已有企业布局PD-L1/TGFβ双抗,其中恒瑞医药、普米斯生物已进入临床开发阶段。
6.冠科美博申请港交所IPO。冠科美博在港交所递交了IPO申请,联系保荐人为摩根士丹利、BofA Securities、华兴资本。冠科美博是一家生物科技公司,拥有拟用于肿瘤治疗的10种候选药物,其中有5款在研新药已进入临床,分别为c-MET抑制剂APL-101(伯瑞替尼)、E-选择素拮抗剂APL-106(uproleselan)、PD-1单抗APL-501、PD-L1单抗APL-502(TQB2450)和靶向Wnt/β-连环蛋白信号通路的小分子抑制剂APL-121(tegavivint)。本次募集资金将用于候选药物研发活动、拓宽在研管线等。
国际药讯
1.FDA公布强生单剂新冠疫苗详细结果。FDA在官网上公布内部科学家对强生旗下杨森候选新冠疫苗Ad26.COV2.S的紧急使用授权(EUA)申请的评估。FDA的科学家表示,Ad26.COV2.S表现出良好的保护效力和安全性。值得一提的是,最新数据显示,在南非进行的临床试验中,Ad26.COV2.S预防出现症状的COVID-19的效力达到64%,与1月底公布的57%相比有所提高。而且,对无症状感染者的初步研究显示,这款疫苗可能将新冠病毒感染风险降低65.5%。2月26日,FDA将召开咨询委员会议,对Ad26.COV2.S进行审评。
2.辉瑞新冠疫苗在以色列大规模接种中保护效力达94%。《新英格兰医学杂志》发表以色列大规模接种辉瑞/BioNTech 新冠疫苗BNT162b2的真实世界研究结果。分析对比了近60万疫苗接种者和未接种者的Covid-19结局(包括经证实的SARS-CoV-2感染、有症状的Covid-19、Covid-19相关住院、重症疾病和死亡)。研究结果显示,两剂接种后其对于预防有症状的Covid-19(新冠肺炎)的效力为94%,与临床试验结果一致。
3.安进斑块状银屑病疗法Otezla申请扩大适用范围。安进PDE4抑制剂Otezla(apremilast)向FDA提交了补充新药申请(sNDA),寻求将其适应症范围扩大至治疗适合光疗或系统治疗的轻度至中度斑块状银屑病(牛皮癣)成人患者。该药此前已获批用于中度至重度的这类患者的治疗。在一项用于治疗轻度至中度斑块状银屑病的Ⅲ期ADVANCE(PSOR-022)试验中,与安慰剂相比,30mgOtezla治疗组第16周时患者的sPGA皮肤评分在统计学上实现了显著改善。
4.创新头颈癌疗法获FDA突破性疗法认定。FDA授予Kura Oncology高选择性法尼基转移酶抑制剂tipifarnib突破性疗法认定,用于治疗携带HRAS基因突变的头颈部鳞状细胞癌(HNSCC)患者。这些患者在接受含铂化疗后疾病出现进展,而且变异等位基因频率≥20%。一项公布于ASCO2020会议上的Ⅱ期临床RUN-HN数据显示,在18例可评估患者中,Tipifarnib达到50%的ORR,中位PFS为5.9个月,中位OS为15.4个月。
5.赛诺菲与Sirion签署基因治疗协议。德国生物技术公司Sirion宣布,将与赛诺菲以及德国海德堡大学医院的合作伙伴德克·格里姆(Dirk Grimm)教授合作,开发新的改良组织选择性腺相关病毒(AAV)载体的基因疗法。Sirion拥有AAV载体制造方面的专业知识和能力,其基础技术shRNA序列算法识别准确率高,敲除结果在90%以上。本次合作的财务条款没有披露,合作的具体目标也尚未对公开。
医药热点
1.国家布局创新中心建设。《国家技术创新中心建设运行管理办法(暂行)》发布,明确科技部会同相关部门和地方政府,根据国家重大区域发展战略部署以及关键领域技术创新需求,有序组织开展创新中心建设。《办法》明确,国家技术创新中心定位于促进重大基础研究成果产业化。创新中心分为综合类和领域类。其中,科技部负责创新中心规划布局和宏观管理。
2.深圳为13类人提供家庭病床服务。深圳市发布《深圳市家庭病床管理办法(试行)》,自2021年3月1日起试行。根据《办法》,社区健康服务机构及其举办医院将可以为因疾病需要卧床或者身体衰弱、生活不能自理的13类人群,定期上门提供诊疗、康复或者护理服务。该《办法》还明确规定,患门诊特定病种的参保人在家庭病床结算期间能同时享受门诊特定病种的社保待遇。
3.注射免疫球蛋白对新冠患者有效。《免疫学前沿》杂志近日发表了来自中国医学科学院北京协和医院感染内科主任李太生教授团队,针对重型新冠肺炎患者治疗方案的多中心回顾性研究结果。该研究对比了26例接受大剂量静脉注射免疫球蛋白治疗患者和89例接受常规标准治疗患者的预后数据。结果显示,对重型新冠肺炎患者,在发病14天内静脉注射大剂量免疫球蛋白,可降低患病28天时的死亡率。
4.法国新型新冠检测法10分钟内出结果。近日,法国科学家称,他们正在开发一种新型新冠病毒检测手段Corial-1。Corial-1采用一种能与手机连接的装置,当拭子样本与装置的电极接触后,会随之产生电流,并在手机上形成图像,在十分钟内就能判断该样本是否感染新冠病毒。目前,该检测手段在对300个样本的测试中,准确率达到90%。
审评动向
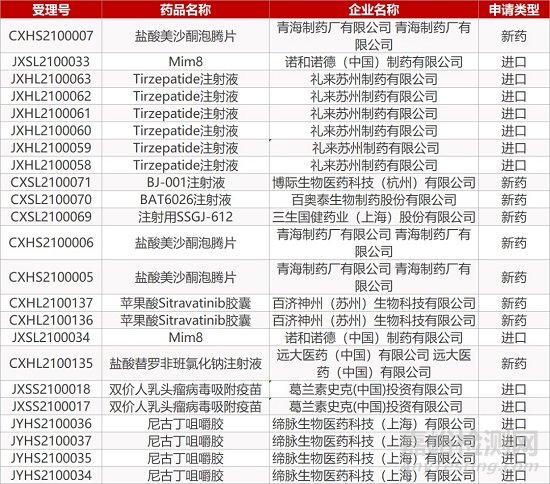
1. CDE新药受理情况(02月25日)
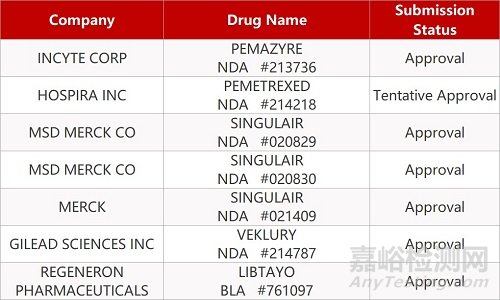
2. FDA新药获批情况(北美02月23日)
股市资讯
【恒瑞医药】SHR-1701联合或不联合苹果酸法米替尼治疗既往系统化疗失败的广泛期小细胞肺癌开放、多中心Ⅱ期研究获得临床批件。
【恩华药业】公司获得国家药监局核准签发的麻精管控类药品盐酸羟考酮注射液3个规格的《药品注册证书》,该药品为强效镇痛药,用于治疗中度至重度急性疼痛,包括手术后引起的中度至重度疼痛,以及需要使用强阿片类药物治疗的重度疼痛。
【贝达药业】公司申报的BPI-361175片用于治疗携带EGFR C797S突变及其他EGFR相关突变的晚期非小细胞肺癌等实体瘤的药品临床试验申请已取得国家药品监督管理局批准。

来源:药研发


