您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-04-06 16:51
题记
从“质量是检测出来的”、到“质量是生产出来的”、再到“质量是设计出来的”,业内对药品质量的认识,在不停的与时俱进着;这一过程,有快乐也有痛苦,快乐的是我们对药品的理解越来越深、对质量的控制越来越强,痛苦的是“思路的转变”、以及一些表面看起来增加的工作量;但不可否认的是,QbD理念对药物研发积极的作用,以及对药物研发人员科研思路更为全面的辅助作用。
QbD的来历
质量源于设计~QbD,相关理念最早源于20世纪70年代Toyota为提高汽车质量而提出的创造性的概念,并经过在通信、航空等领域的发展逐渐形成。1985年,著名质量管理学家Julan博士在总结其质量管控经验和方法的基础上,提出质量源于设计(quality bydesign,QbD),该理论同Deming的质量十四点原则和PDCA循环、Feigenbaum的全面质量管理、今井正明的持续改善等方法和理念共同奠定了现代质量管理的基础。
对于药品行业,当人们已经普遍接受药品质量是生产出来的,不是检测出来的质量理念之后,美国制药业开始深入探讨QbD。进入21世纪,美国FDA开始在药品管理中引入QbD理念,QbD也逐渐在药品监控系统中发挥着越来越重要的作用。所谓QbD,广义定义为:在可靠的科学管理和质量风险管理基础之上,预先定义好目标并强调对产品与工艺的理解及工艺控制的一个系统的研发方法。
根据QbD的概念,药品从研发开始就要考虑最终产品的质量。在处方设计、工艺路线确定、工艺参数选择、物料控制等各个方面都要进行深入地研究,积累翔实的数据,在透彻理解的基础上,确定最佳的产品处方和生产工艺。
而从技术的角度,QbD应用的主要内容包括:设计符合患者需求的药品;设计始终符合关键质量属性的工艺;通过质量体系整合开发过程中获取的产品及工艺知识;理解处方成分及工艺参数对产品质量的影响;识别和控制关键工艺变量;持续监控及更新工艺以保证质量的一致性。
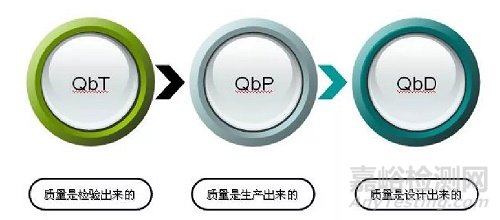
图1 质量概念的不断升级
FDA与QbD的渊源
美国FDA提出QbD,绝非心血来潮搞事情,可以说,是在血泪中总结而出......
20世纪40年代初,为了应对大量的药物致死事件,GMPs标准建立,而GMP控制质量的主要方式是质量源于检测,即QbT;20世纪60年代初,为应对药物“反应停”导致1万多名婴儿畸形的事件,颁布了《Kefauver-Harris药品修正案》,从而保证药物的安全性和有效性;2002年,FDA发布了cGMP;2004年,FDA再次对cGMP进行了升级,发表了《Pharmaceutical CGMPs for the 21st century – A Risk Based Approach》,报告一文中正式提出了QbD的概念,并且被人用药品注册技术规定国际协调会议ICH纳入质量体系中(part3详谈)。
FDA对QbD的推广,主要包括FDA的新药质量评审办公室根据对产品和工艺理解的应用建立了基于风险的药物质量评审体系(PQAS)和通过允许制药企业递交包含QbD原则应用、产品知识和工艺理解的新药申请来运行QbD实施计划;CDER的仿制药办公室OGD实施问卷式评审QbD的仿制药评审模式;CDER的合规办公室OC通过优化预批准的检查环节来评价商业环节的可行性及确认流程控制是否符合ICH Q10质量体系生命周期的要求来进一步推动QbD的执行,以及进行QbD在生物许可申请中的应用。
虽然通过QbD可以更好的对产品质量进行设计预测,但中试和商业生产实践验证工序和原材料的实际表现也是很重要的。FDA在2011年1月发布了工序验证指南强调了制药公司需要持续地积累制药相关知识的数据库,通过药品的全生命周期的持续调整来确保制造中产生的问题能够从根源上被改进。
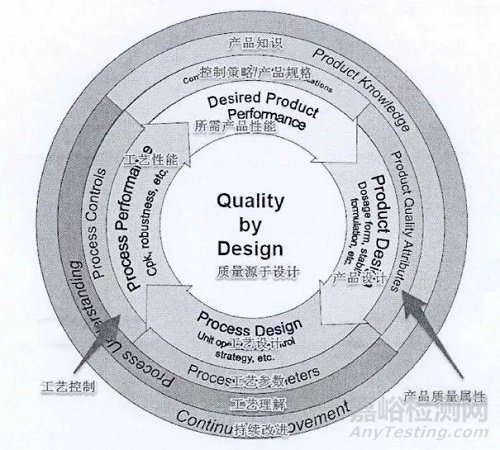
图2 FDA“质量源于设计”模型
ICH~QbD~Q8&Q9&Q10&Q11
上面说到,在FDA提出QbD后,ICH迅速将其纳入到自己的质量体系当中。ICH对QbD的定义为,“以可靠的科学知识作为基石,对药品质量的风险进行科学合理的评估和控制,并强调对产品与工艺的深刻理解,最终达到理想的质量目标,这是一个系统的研发方法”。
2005年,ICH发布相关指南~关于药物开发的Q8和关于质量风险管理的Q9。在Q8里结合试验设计(Designof Experiments,DoE)介绍了质量源于设计QbD和设计空间(Design Space,DS)的概念;Q9介绍了质量风险控制的原则和在药物开发和生产中的应用实例。2008年,ICH发布了关于制药质量体系的Q10,系统地介绍了产品生命周期质量目标的设定和达成。
♪♪♪~ ICH Q8
包括两大部分:药物研发(第1部分)及其补充内容(第2部分),详细介绍了在药品及其生产工艺的研发过程中如何应用科学策略和质量风险管理策略获取对产品和生产工艺的全面理解,从而为设计空间、质量标准和生产控制策略的制订提供科学依据,并为药品质量的风险管理提供坚实基础。其核心内容即为QbD。其中,ICH Q8第1部分对于可能影响药品质量的各因素在研发过程中需要考察的内容进行了详细指导,见下表。

♪♪♪~ ICH Q9
ICHQ9质量风险管理是QbD系统的核心策略之一,有效的质量风险管理采用主动策略识别药物研发和生产阶段的潜在质量问题并加以控制,能够更高程度地保障药品的高质量,而且还有助于管理当局和申报企业均能更加科学、有效地进行风险决策。ICH Q9重点介绍了质量风险管理的原则和常用分析工具。其中,质量风险管理的两个重要原则为:一、风险评估应该基于科学并用于最终保护患者利益;二、风险管理的投入应该与风险等级对应,风险等级越高,管理投入应越大。质量风险管理常规步骤,见下表。
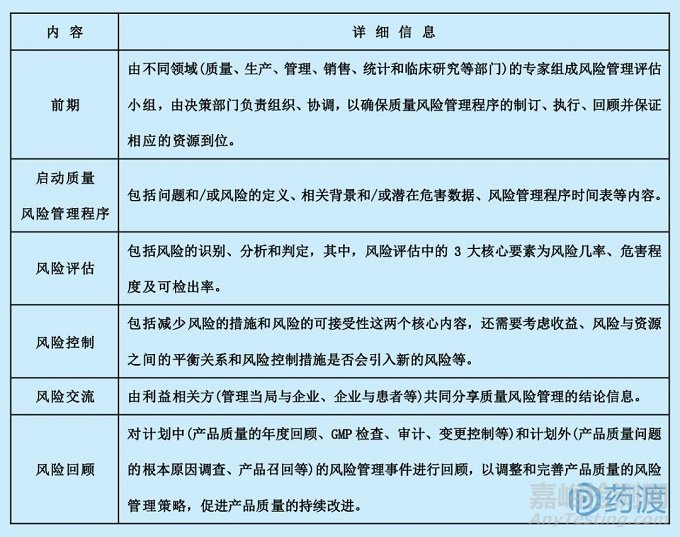
♪♪♪~ ICH Q10
药品质量系统 (pharmaceutical quality system) ICH Q10详细阐述了如何采用QbD的理念、应用科学管理和质量风险管理这两大核心工具建立有效的药品质量系统。其中,科学管理依据已知的科学知识和在该药品生命周期内(药物研发、技术转移、商业化生产和产品停产)获得的对产品及其工艺的全面理解。
药品质量系统的目标:获得符合目标产品质量属性要求的产品、建立并维持产品的受控状态以及促进产品质量的持续改进。药品质量系统的要素包括:工艺性能和产品质量的监控系统、校正和预防措施系统、变更管理系统以及工艺性能和产品质量的管理回顾。在产品周期的各阶段(药物研发、技术转移、商业化生产和产品停产)均需要贯彻实施这4大要素,见下表。

♪♪♪~ ICH Q11
ICHQ11重点关注了原料药的开发和制造,制药公司在开发原料药过程中可以按照“传统”或“强化”的方法或联合两种方法进行。在传统的方法中,对工艺参数设定数据或者范围,原料药的控制策略通常是基于过程的重复性和测试,可以满足既定的验收标准。而强化方法更加广泛地使用风险管理以及科学知识来识别和理解影响关键质量属性(CQA)的工艺参数和单元操作,并在原料药整个生命周期中应用恰当的控制策略,其中也包括建立设计空间(详情见下表)。根据 ICH Q11,制造工艺的开发至少应包括:识别与原料药相关的潜在CQA;使影响药品质量的这些特点可以研究和控制;定义一个适当的制造过程;定义控制策略,以确保工艺过程和原料药质量。

全球对Qbd的研究状态
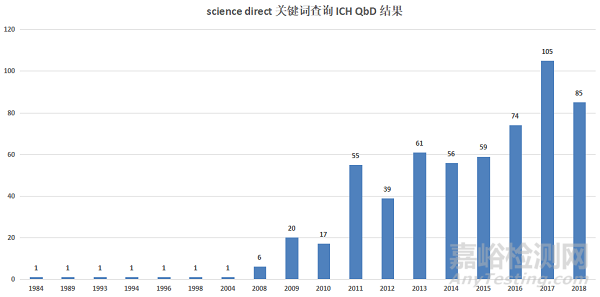
截至发稿,笔者通过查询“sciencedirect”网站,关键词输入“FDA QbD”发现,2008年之前(包含2008),文献量极少,自2009年之后,文献量开始增多,其中,2011年之后明显增多;而文献类型方面,综述、研究、书籍章节相对较多;关键词输入“ICH QbD”,趋势同上(详情见下图);而关键词输入“quality by design”进行搜索,文献量则相对较为巨大,2000年之前便有数十万条相关文献,这则说明两个问题,一个是QbD在全球各行各业的研究使用,都是很多的,另一个则说明,药品行业在引入QbD理论方面,还是有些迟滞了。
FDA关于QbD的CMC试点计划
首先,FDA认为,虽然QbD原理提出时间不长,但实际药品研发企业在药品质量控制过程中,已进行了很多QbD的实践,只是未曾上升到理论的高度。2005年7月,FDA组织了一项CMC试点计划(ChemicalManufacture and Control Pilot Program),招募了9个企业的11个项目进行QbD注册申报试点,希望提供一定的机会使得基于QbD原理形成的质量控制信息可在注册申报时提交,同时也增加FDA对该体系的实践认识。
在这一过程中,“宇宙大药厂”辉瑞表现突出,其在伐尼克兰制剂(varenicline tablets)和马拉韦罗制剂(maraviroc tablets)的新药申请中参与了FDA的CMC试点计划,且对伐尼克兰的生产过程进行变更,从而实现了上市后监管的灵活性,这一计划在当时预期为辉瑞节省2亿美元,而伐尼克兰制剂和马拉韦罗制剂新药申请文件中所描述的新的QbD范例,不仅增加了科学细节和对生产过程的理解,也推进了美国、欧洲和日木的监管审评和批准。
通过多年实践经验总结,大部分企业都认为QbD的实施,使得药品生命周期的流程更加规范化,可以快速有效地降低药品生命周期的综合成本,加快药品的上市进程。且要进一步强调的是,QbD的理想状态是一个三赢结果:即对生产者来说,可以减少监管压力和降低生产成本;对监管者来说,可以在不牺牲质量的前提下减小监管压力;对病人来说,可以获得有效的药物,产品质量有更好的保证。
药企对QbD的反应态度
首先,客观存在的问题是“通常一个新药的专利保护期有10多年,在这期间,尽管科学技术有很大突破,但制药企业几乎都不愿意改进工艺和管理规程,因为这些方面的修改必须向FDA 提出申请,既耽误时间,又有风险”;但也有业内人士认为,“这对制药企业来说是好事,可以节省20%~50%的成本,但前提是企业要投资作充分的QbD研究”。
在这一过程中,原研药产业的创新者们对ICH Q8、Q9和Q10法规的优点不断地进行争论;而相反的是,众多仿制药公司却很少讨论ICH Q8和Q9的优点,而是默默地领会QbD的原则并将其应用到现有的商业模式中去;如梯瓦、迈兰等主要的仿制药制造商通过深刻领会QbD、PAT等来争取实现第一个申报仿制药的ANDA来获得竞争优势。
虽然,美国默克药厂的Januvia成为了第一个应用QbD理念通过审评的药物(2006)。但这里还是要介绍下辉瑞...自QbD推广之后,辉瑞公司便将QbD概念性方法在其RFT(RightFirst Time)过程中得到体现。RFT于2005年在辉瑞全公司范围内开始推广,通过RFT和QbD相辅相成的应用对其所有项目做出评价。RFT的意思是第一次就做对,主要目的是在“发展对生产过程的理解以便不断改进”。生产过程理解和产品知识的提高可以使产品得到不断改进,并提供机会来利用增强的知识在监管申请中获益。
辉瑞在多个公开讨论会上展示了QbD申报和其他产品的实例,分享了在ICH地区的经验和教训,并与新兴市场国家(包括中国在内)的监管机构展开讨论。辉瑞对一些QbD监管说明范例的形成作出了显著贡献,包括欧洲制药工业协会联合会(EFPIA) MOCK P2例证文件(Examplain)和MockS. 2文件、日本Mock J-QOS(质量综述)。在欧洲、日本、澳大利亚和新西兰,伐尼克兰片剂和马拉韦罗片剂的QbD注册文件因所提供的信息证明了对生产过程理解的增强而获得监管部门的认可。在加拿大,辉瑞基于科学风险评价为生产工艺设计空间提供了合理和令人信服的解释,因此通过与监管部门的谈判减少了监管限制。在快速领会、应用QbD之后,辉瑞也迎来了各方面的收获。
QbD对于一致性评价的好处
近两年,国内药品行业最热的关键词非“一致性”莫属,而对于一致性评价,QbD如应用得当,是有非常多的好处的。且不得不说,前些年国内仿制药药品质量良莠不齐,很大一部分的原因是企业不愿意对产品进行深入的研究,只要获得合格的参数即可(而这个数据的来源就多种多样了...),而粗糙的研发过程也终酿苦果...
QbD在一致性评价中的运用主要分为以下步骤:1)根据参比制剂确定目标产品的质量概况和质量参数;2)确定产品的关键质量属性、关键工艺参数;3)研发生产工艺的设计空间;4)实行全面质量控制,持续生产高质量的产品。其好处主要有以下几点:
☆利于研发
缺乏正确的流程是制约仿制药一致性评价的重要因素之一。在一定时期内,仿制药研发是基于简单实验来确定初步的处方和工艺,缺乏规范的研发流程。通过研究分析参比制剂和原料特性,考察其关键的质量属性与原辅料和工艺参数的关联性,确定正常的操作空间,在研发阶段就设计好稳定、高效的工艺流程,有利于提高仿制药BE的通过率。
☆利于生产
在规范的操作空间生产,严格控制原辅料和中间体的关键属性和关键工艺参数,从源头上控制最终产品的质量;关注产品质量属性的形成过程,而非仅仅是实验室的检验结果,以确保产品质量的可持续性。
☆利于监管
目前,我国药品检验的主要目的还不是反映药品的品质,而是说明药品符合注册标准。基于QbD理念,药监部门可以有的放矢,重点监管原辅料和中间体的关键属性、关键工艺参数,从而提高监管效率。
☆利于审评
详细、系统地研究原研药和仿制药CQAs与原辅料、工艺参数的关联性,确定正常的操作空间,有利于提升仿制药的质量和申报资料的规范性,提高通过审评的可能性。质量源于设计理念在一致性评价中的运用由于历史与国情等各方面的原因,我国一些仿制药获批上市时开展的临床试验成功率高于国际水平。随着国家药品监督管理局所要求的临床试验规范化和监管力度的大幅提升,如何通过前期深入完整的药学研究来提高后期临床试验的成功率,是企业面临的重要问题。
质量设计思维
这里要先说一下,笔者更倾向于将QbD理解为内功心法,而这种心法其实就是要建立更为完善的质量设计思维。“设”即假设与想象,“计”即计划、策略与方法,设计就是通过计划、策略和方法将设想在现实中实现的过程。
在产品开发中,设计的核心是推理的过程,即从产品的价值出发,对需求、功能和属性,直至产品的最终形态和使用条件进行反绎推理的过程。设计从观念、思维方法、知识和评价体系等各方面来整合科学,弄清事物的本质,因此设计对产品质量起着决定性作用。QbD强调“以终为始”,是对设计思维的贯彻。以终为始即以临床患者为目的、为根本,先分析理解患者的需求,再把问题分解为对药品的功能要求(即QTPP),将药品治疗功能赋予恰当的理化、生物学特征,再找到合理的药物开发和制造方案,最后组合各级控制策略形成全局的解决方案,实现特定的药品功能并满足预期的需求。此心法也!

来源:药渡


